Matières
Niveaux
Selon la théorie des collisions, la vitesse d’une réaction chimique dépend du nombre de collisions entre les particules des réactifs, de leur orientation et de leur énergie cinétique.
Selon la théorie des collisions, une réaction chimique a lieu lorsque les trois conditions suivantes sont respectées.
Les particules de réactifs doivent entrer en collision entre elles.
Les particules de réactifs doivent entrer en collision selon une orientation favorable.
Les particules qui participent à une collision doivent posséder une énergie cinétique |(E_k)| égale, ou plus élevée, à l’énergie d’activation |(E_a)| nécessaire pour former un complexe activé.
Lorsque des particules de réactifs possèdent une énergie cinétique suffisante et qu’elles entrent en collision selon une orientation favorable, on dit que la collision est efficace. Si l’une de ces conditions n’est pas respectée, on dit que la collision est inefficace ou élastique.
La vitesse d’une réaction chimique est directement proportionnelle au nombre de collisions efficaces.
Pour qu’une réaction chimique se produise, il faut d’abord que les particules de réactifs entrent en collision. Plus il y a de collisions entre les particules de réactifs, plus le nombre de collisions efficaces est élevé. Le nombre de collisions efficaces dépend des facteurs suivants :
Si l’angle de collision entre les particules de réactifs n’est pas optimal, les particules rebondissent les unes sur les autres sans qu’aucune liaison ne soit brisée. Lorsque l’angle de collision entre les particules de réactifs est optimal, la collision peut permettre aux particules de réactifs de se réorganiser de manière à former un complexe activé, ce qui rend la réaction chimique possible.
La situation peut être expliquée par l’analogie suivante : pour couper une buche en deux, la hache doit frapper la buche selon une orientation spécifique. Si on frappe la buche avec le côté plat de la hache plutôt qu’avec le côté tranchant, celle-ci ne se sépare pas et demeure en un morceau.
Les deux images suivantes montrent la collision entre les deux mêmes particules de réactifs, mais selon des orientations différentes.
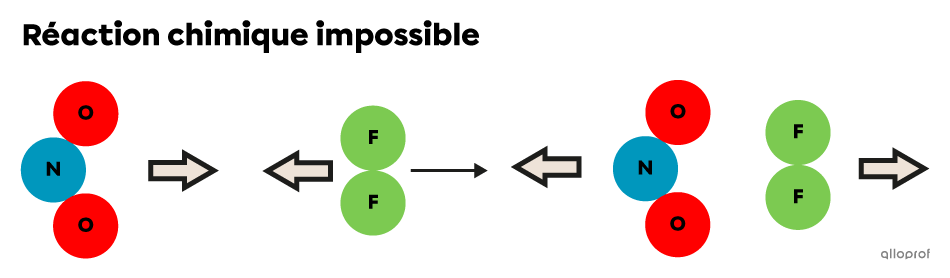
L’orientation des deux particules de réactifs (|\text{NO}_2| et |\text{F}_2|) n’est pas optimale lors de leur collision. Elles rebondissent en conservant leur structure.
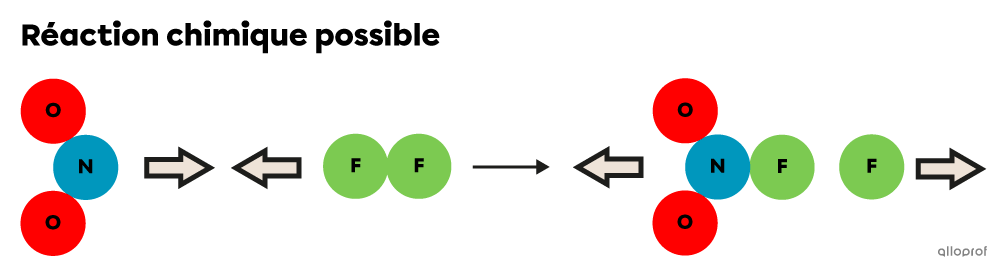
L’orientation des deux particules de réactifs (|\text{NO}_2| et |\text{F}_2|) est optimale lors de leur collision, ce qui permet la formation de nouveaux produits.
Pour qu’une réaction chimique se produise, les collisions doivent libérer une quantité minimale d’énergie pour briser les liaisons entre les atomes. Cette énergie provient de l’énergie cinétique des particules de réactifs avant qu’elles entrent en collision.
Selon la distribution de Maxwell-Boltzmann, les particules qui composent une substance ont des vitesses différentes, et ce, à une même température. Puisque l’énergie cinétique |(E_k)| d’une particule est proportionnelle au carré de sa vitesse, cette distribution représente également l’énergie cinétique des particules.
Cette distribution montre que l’énergie cinétique |(E_k)| d’une grande partie des particules de réactifs est inférieure à l’énergie d’activation |(E_a).| Les collisions entre ces particules sont donc inefficaces, ou élastiques, ce qui ne permet pas de former des produits. Seulement les particules dont l’énergie cinétique |(E_k)| est égale ou supérieure à l’énergie d’activation |(E_a)| peuvent faire des collisions efficaces et participer à la réaction chimique en formant un complexe activé.

Les particules dont l’énergie cinétique |(E_k)| est inférieure à l’énergie d’activation rebondissent les unes sur les autres, et ce, même si leur orientation est optimale lors de la collision. L’énergie cinétique des particules est conservée. Il s’agit donc de collisions élastiques.
Les particules dont l’énergie cinétique est égale ou supérieure à l’énergie d’activation et dont l’orientation est optimale peuvent faire des collisions efficaces et former un complexe activé. En raison des transferts d’énergie lors de la réaction, l’énergie cinétique des particules de produits est différente de celle des particules de réactifs.
Si on reprend l’analogie d’une buche qu’on coupe avec une hache, une buche ne peut pas être coupée si la vitesse de la hache n’est pas suffisante, et ce, même si la hache est orientée de manière optimale par rapport à la buche.
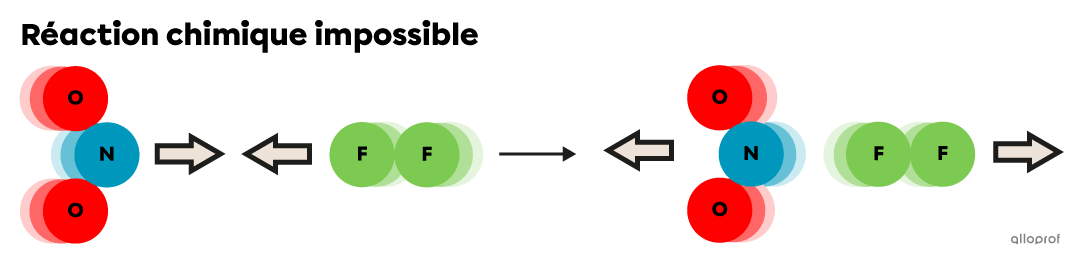
Quand l’énergie cinétique |(E_k)| des particules de réactifs |(\text{NO}_2| et |\text{F}_2)| est inférieure à l’énergie d’activation |(E_a)| de la réaction, elles subissent des collisions élastiques et chacune conserve son énergie cinétique |(E_k).|
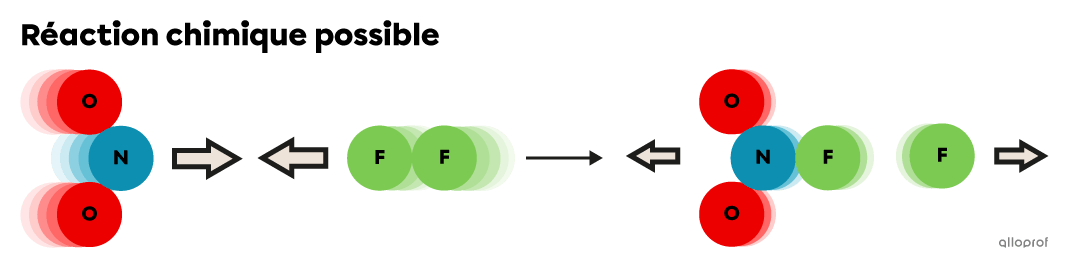
Quand l’énergie cinétique |(E_k)| des particules de réactifs |(\text{NO}_2| et |\text{F}_2)| est égale ou supérieure à l’énergie d’activation |(E_a)| de la réaction, elles subissent des collisions efficaces, ce qui permet la formation de produits.
La théorie des collisions permet d’expliquer une réaction complexe en analysant les réactions élémentaires de son mécanisme réactionnel.
Une réaction élémentaire correspond à une réaction chimique qui se déroule en une seule étape.
Une réaction complexe est une réaction chimique qui se déroule en deux étapes ou plus. Elle est composée de plusieurs réactions élémentaires différentes.
Un mécanisme réactionnel correspond à la suite de réactions élémentaires permettant de transformer les réactifs d’une réaction complexe en produits, en passant par au moins un intermédiaire de réaction.
Un intermédiaire de réaction est une substance présente dans une réaction élémentaire d’un mécanisme réactionnel sans toutefois faire partie de sa réaction globale.
Une réaction globale est la représentation sommaire d’une réaction chimique complexe, indiquant les réactifs de départ et les produits obtenus à la fin de la réaction.

Moments dans la vidéo :
Une réaction élémentaire se déroule en une seule étape. Autrement dit, chaque collision efficace entre les particules des réactifs entraine la formation d’un seul complexe activé, qui forme ensuite les produits finaux de la réaction. Une réaction élémentaire correspond également à l’une des étapes d’un mécanisme réactionnel.
Dans une réaction élémentaire, les collisions efficaces entre les particules de réactifs engendrent la formation d’un seul complexe activé. Au cours d’une réaction chimique, c’est le complexe activé qui atteint le niveau d’enthalpie le plus élevé.
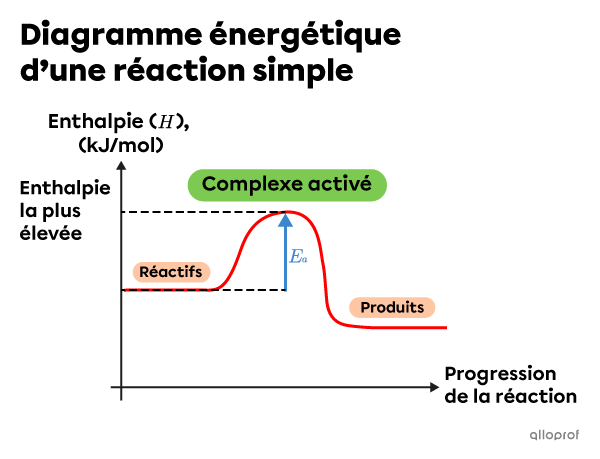
Note : Dans le diagramme énergétique ci-dessus, les produits ont une enthalpie inférieure aux réactifs. Il s’agit donc d’une réaction exothermique.
Une réaction complexe nécessite qu’il se produise des collisions efficaces entre plus de deux substances différentes. Toutefois, il est très peu probable que plus de deux particules de réactifs entrent en collision simultanément avec une énergie cinétique suffisante selon une orientation optimale. Ainsi, une réaction complexe se déroule en plusieurs étapes, où chaque étape correspond à une réaction élémentaire différente comprenant seulement deux réactifs. L’ensemble des réactions élémentaires forme le mécanisme réactionnel de la réaction complexe.
Chaque réaction élémentaire qui compose une réaction complexe a ses propres caractéristiques, soit son énergie d’activation |(E_a),| son complexe activé, sa variation d’enthalpie et sa vitesse de réaction. Ces caractéristiques sont représentées dans le diagramme énergétique du mécanisme réactionnel de la réaction complexe.
Lors d’une réaction complexe, certaines substances sont produites par une réaction élémentaire et consumées par la réaction élémentaire suivante. Ces substances qui participent à la réaction complexe, mais qui ne sont pas des réactifs de départ ou des produits finaux de la réaction sont appelées des intermédiaires de réaction.
Dans le diagramme énergétique d’un mécanisme réactionnel, on retrouve les intermédiaires de réaction entre les complexes activés des différentes réactions élémentaires, tel qu’illustré dans le diagramme suivant. Toutefois, toutes les substances présentes à ces moments de la réaction ne sont pas nécessairement des intermédiaires de réaction. Certaines substances présentes à ces moments sont également des réactifs de départ ou des produits finaux de la réaction complexe.
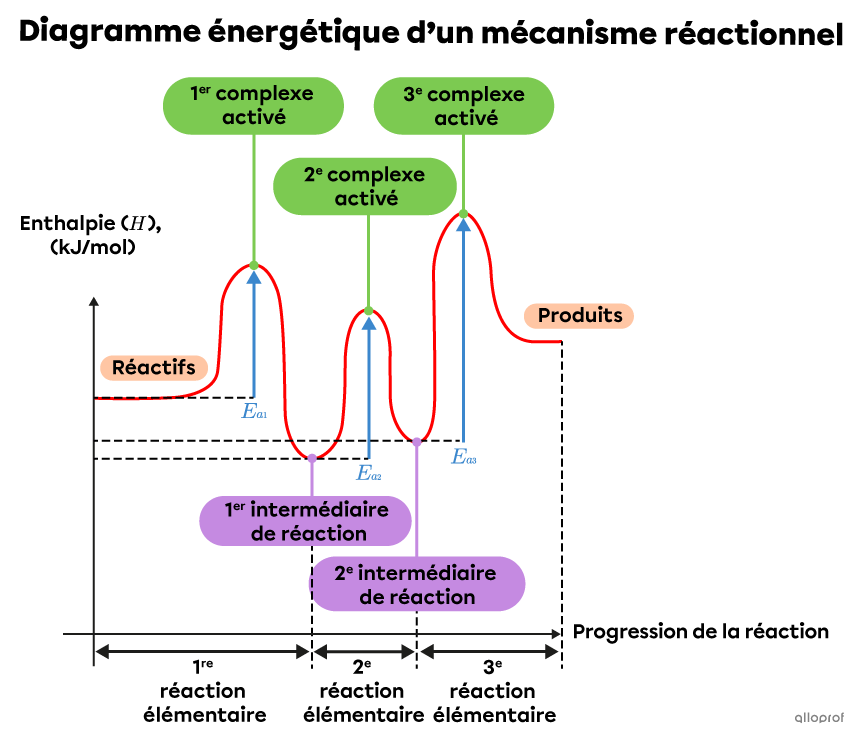
Le mécanisme réactionnel d’une réaction complexe comprenant trois réactions élémentaires, comme l’indique la présence de trois complexes activés dans le diagramme énergétique ci-dessus.
Note : Le diagramme énergétique ci-dessus présente une réaction endothermique, puisque l’enthalpie des produits finaux est supérieure à celle des réactifs de départ.
Une réaction complexe ne peut être plus rapide que sa réaction élémentaire la plus lente. Pour cette raison, c’est la réaction élémentaire la plus lente d’un mécanisme réactionnel qui détermine la vitesse d’une réaction complexe. Cette réaction est appelée l’étape déterminante. Sur le diagramme énergétique d’une réaction complexe, l’étape déterminante correspond à la réaction élémentaire qui possède la plus grande énergie d’activation |(E_a)|.

Moments dans la vidéo :
Certains manuels définissent l’étape déterminante comme la réaction élémentaire dont le complexe activé possède la plus grande enthalpie. Toutefois, l’étape déterminante correspond à la réaction élémentaire qui a la plus grande énergie d’activation |(E_a).|
Voici le diagramme énergétique du mécanisme réactionnel d’une réaction complexe.
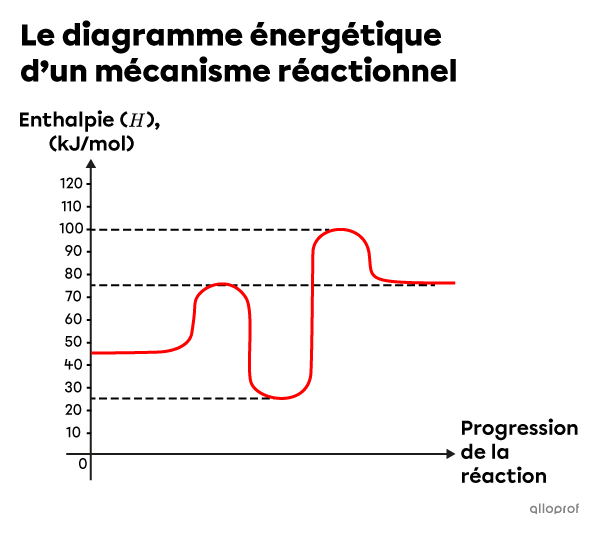
Détermine le nombre de réactions élémentaires que contient la réaction complexe illustrée.
Détermine l’enthalpie du ou des intermédiaires de réaction.
Détermine l’énergie d’activation de chaque étape du mécanisme réactionnel.
Identifie l’étape déterminante.
Une réaction complexe entre du dioxyde d’azote |(\text{NO}_2)| et du difluor |(\text{F}_2)| permet de former du fluorure de nitryle |(\text{NO}_2\text{F}_{\text{(g)}}),| comme l’indique la réaction globale suivante.
|2\ \text{NO}_{2\text{(g)}} + \text{F}_{2\text{(g)}} → 2\ \text{NO}_2\text{F}_{\text{(g)}}|
Le mécanisme réactionnel de cette réaction complexe comprend les deux réactions élémentaires suivantes, où la première réaction élémentaire est plus lente que la seconde.
Réaction élémentaire 1 : |\text{NO}_{2\text{(g)}}\ + \text{F}_{2\text{(g)}} \rightarrow\ \text{NO}_2\text{F}_{\text{(g)}} + \text{F}_{\text{(g)}}|
Réaction élémentaire 2 : |\text{F}_{\text{(g)}} + \text{NO}_{2\text{(g)}} → \text{NO}_2\text{F}_{\text{(g)}}|
a) Identifie l'intermédiaire de réaction.
b) Identifie l’étape déterminante du mécanisme réactionnel.

Moments dans la vidéo :