Matières
Niveaux
Le changement d’état, ou changement de phase, est le passage d’un état de la matière à un autre.
La distance entre les particules d'une substance varie selon son état.
À l'état solide, les particules sont très rapprochées les unes des autres.
À l'état liquide, les particules sont moyennement rapprochées les unes des autres.
À l'état gazeux, les particules sont éloignées les unes des autres.
Une substance peut passer d'un état à un autre lorsque la distance entre ses particules change. La distance entre les particules d'une substance est influencée, entre autres, par la température.
Si la température de la substance augmente, c’est que la substance absorbe de l'énergie. Ses particules ont tendance à s'agiter et à s'éloigner les unes des autres.
Si la température de la substance diminue, c’est que la substance dégage de l'énergie. Ses particules ont tendance à ralentir et à se rapprocher les unes des autres.
Lors d’un changement d’état, la substance absorbe ou dégage de l’énergie, mais sa nature ne change pas. C’est donc un changement physique.
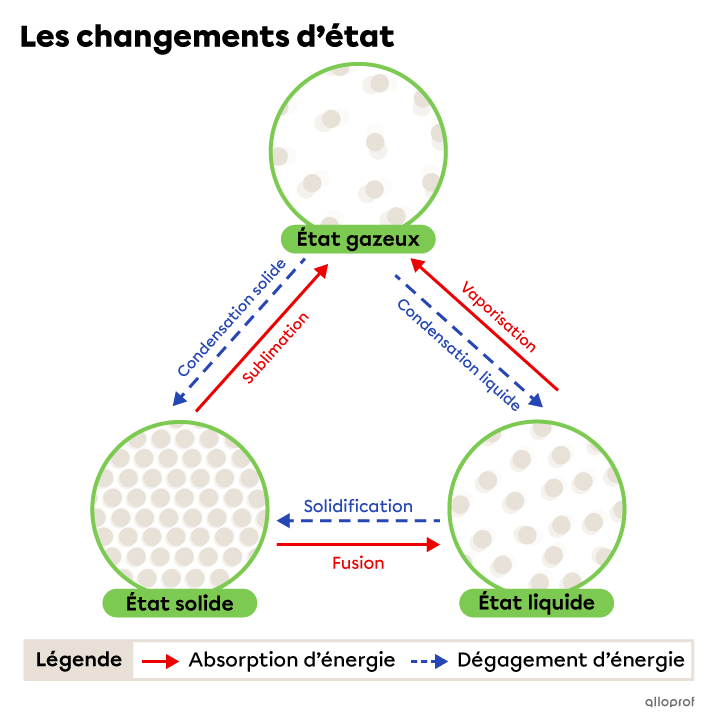
Les changements d’état suivants se produisent grâce à une absorption d’énergie.
Les changements d’état suivants se produisent grâce à un dégagement d'énergie.
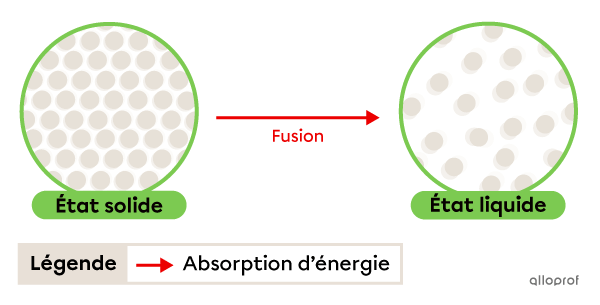
La fusion est le passage de l’état solide à l’état liquide. Elle se produit grâce à une absorption d’énergie.
La température à laquelle se déroule ce changement d'état est appelée température de fusion, ou point de fusion. Il s’agit d’une propriété physique caractéristique.
La fusion
La glace qui fond au printemps est un exemple de fusion. Lorsque la température augmente, la glace absorbe de la chaleur (absorbe de l’énergie) et devient sous forme liquide.

De la glace qui fond
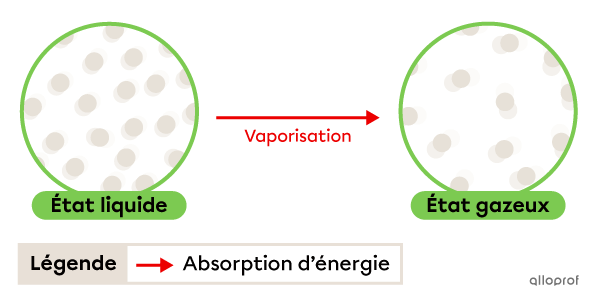
La vaporisation est le passage de l’état liquide à l’état gazeux.
Lorsque la vaporisation se fait rapidement et avec un apport de chaleur, on l’appelle ébullition. La température à laquelle se déroule ce changement d'état est appelée température d’ébullition, ou point d’ébullition. Il s’agit d’une propriété physique caractéristique.
Lorsque la vaporisation se fait lentement et à température ambiante, on l’appelle évaporation. L’évaporation a lieu à une température plus basse que le point d’ébullition.
La vaporisation
De l’eau qui bout est un exemple de vaporisation. Plus précisément, il s’agit d’ébullition, puisque la vaporisation se fait rapidement. L’eau absorbe la chaleur du poêle (absorbe de l’énergie) et elle devient à l’état gazeux.

De l’eau qui bout
Des vêtements mouillés qui sèchent sont un exemple de vaporisation. Plus précisément, il s’agit d’évaporation, puisque la vaporisation de l’eau se fait lentement et à une température plus basse que son point d’ébullition.

Des vêtements qui sèchent
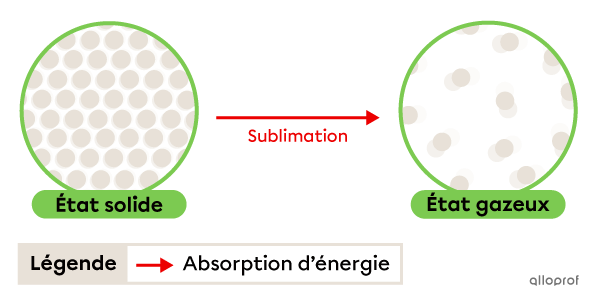
La sublimation est le passage de l’état solide à l’état gazeux. Elle se produit grâce à une absorption d’énergie.
La sublimation
La glace sèche est du gaz carbonique (CO2) sous forme solide. Le gaz carbonique est solide à une température inférieure à -78 °C et il est gazeux à une température supérieure à -78 °C. Lorsque la glace sèche est placée dans un milieu à température ambiante, elle se sublime. Elle passe directement de l’état solide à l’état gazeux, sans passer par l’état liquide. C’est pourquoi on l’appelle glace sèche.

De la glace sèche qui se sublime
La solidification est le passage de l’état liquide à l’état solide. Elle se produit grâce à un dégagement d’énergie.
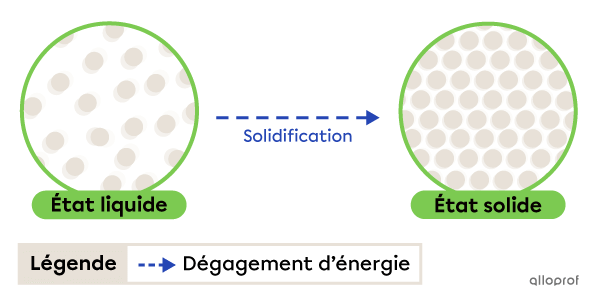
La solidification
L’eau qui gèle à la surface d’un lac est un exemple de solidification. La température extérieure diminue, l’eau du lac perd de la chaleur (dégage de l’énergie) et devient sous forme solide.

Un lac gelé
La condensation liquide est le passage de l’état gazeux à l’état liquide. Elle se produit grâce à un dégagement d’énergie.
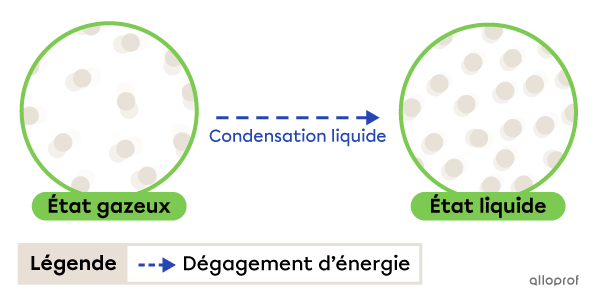
La condensation liquide
La buée qui se forme sur les fenêtres est un exemple de condensation liquide. Au contact de la fenêtre froide, la vapeur d’eau contenue dans l’air perd de la chaleur (dégage de l’énergie) et devient sous forme liquide.

De la buée
La condensation solide est le passage de l’état gazeux à l’état solide. Elle se produit grâce à un dégagement d’énergie.
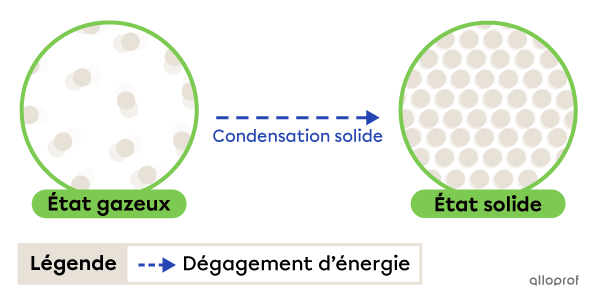
La condensation solide
Le givre qui se forme sur le gazon le matin est un exemple de condensation solide. Au contact du gazon froid, la vapeur d’eau contenue dans l’air perd de la chaleur (dégage de l’énergie) et devient sous forme solide.

Du givre

Le diagramme de changement d’état, ou diagramme de changement de phase, d’une substance est un graphique de la température de la substance en fonction du temps dans lequel on observe des plateaux correspondant aux changements d’état.
Lorsqu’une substance est en train de changer d’état, sa température ne varie pas. Toute l’énergie absorbée ou dégagée sert à faire passer la substance d’un état à un autre.
Si on chauffe ou on refroidit une substance et qu’on note la température en fonction du temps, on observe des plateaux qui correspondent aux changements d’état. Ce diagramme permet de déterminer les températures de changement d’état d’une substance, soit le point de fusion et le point d’ébullition.
Si on chauffe de la glace dans un contenant fermé jusqu’à ce qu’elle se transforme complètement en vapeur, on obtient un graphique de la température de l’eau en fonction du temps similaire à celui-ci.
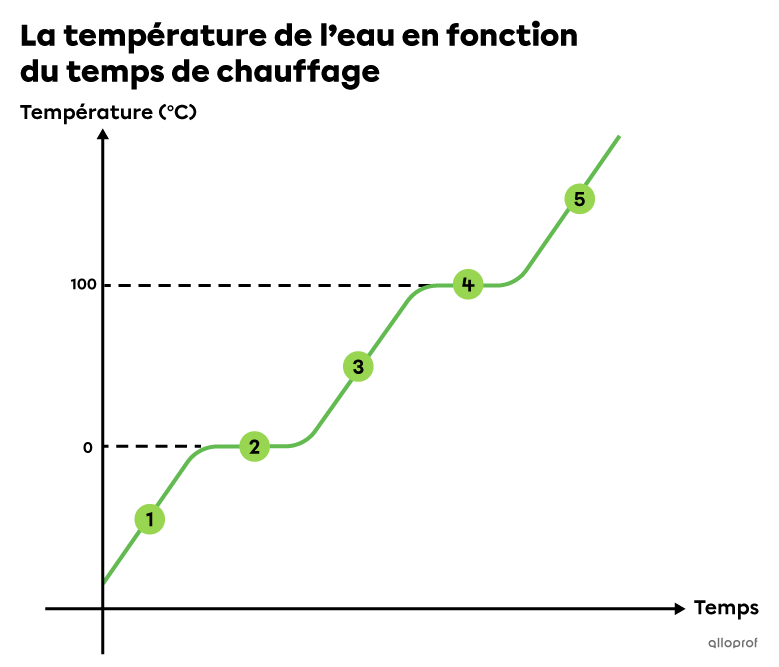
Par ailleurs, si on refroidit de la vapeur d’eau dans un contenant fermé jusqu’à ce qu’elle se transforme complètement en glace, on obtient un graphique de la température de l’eau en fonction du temps similaire à celui-ci.

Pour valider ta compréhension à propos des états de la matière de façon interactive, consulte la MiniRécup suivante.
