Matières
Niveaux
L’électrolyse de l’eau est le procédé qui, à l'aide d'un courant électrique, permet la séparation de la molécule en ses deux éléments.
La molécule d'eau, |H_{2}O|, est une molécule formée par deux atomes d'hydrogène et un atome d'oxygène. Il s'agit d'une substance pure qui ne peut être brisée par des moyens physiques. On doit plutôt faire subir un changement chimique à la molécule afin d'en séparer les différents constituants.
En effet, un composé tel que l'eau, c'est-à-dire une molécule formée par la combinaison de deux ou plusieurs éléments, peut être divisé par des transformations chimiques. Le procédé par lequel on effectue la décomposition de l'eau se nomme électrolyse. Grâce à un courant électrique qu'on fait passer dans l'eau, on obtient deux gaz: le dihydrogène et le dioxygène. L'équation suivante représente la décomposition de l'eau:
|2 H_{2}O_{(l)} \rightarrow O_{2(g)}+ 2 H_{2(g)}|

Expérimentalement, on peut réaliser l'électrolyse de l'eau. Pour ce faire, il suffit d'avoir une source de courant, une solution acide et deux électrodes et de réaliser le montage suivant:
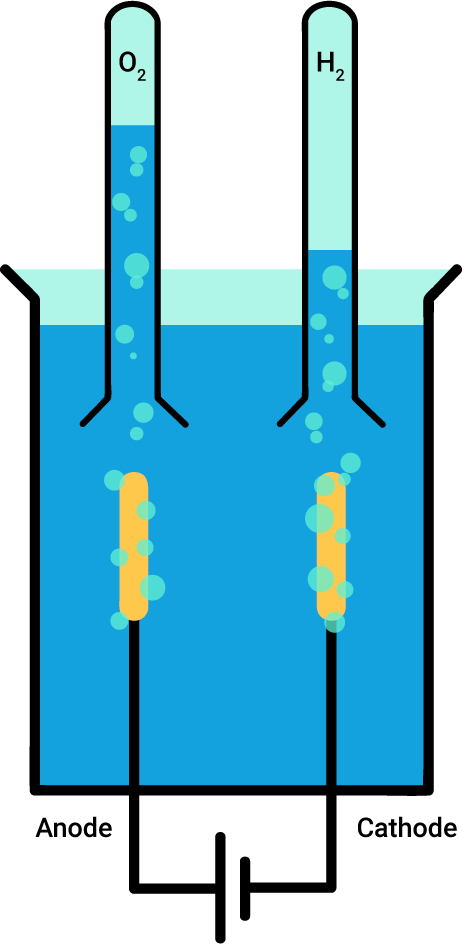

L’expérience donne des résultats qui correspondent à l'équation chimique de l'électrolyse de l'eau: