
Ce contenu est protégé par le droit d'auteur. Toute reproduction à l'extérieur des forums Alloprof est interdite et pourra être considérée comme une violation du droit d'auteur.

Ce contenu est protégé par le droit d'auteur. Toute reproduction à l'extérieur des forums Alloprof est interdite et pourra être considérée comme une violation du droit d'auteur.

Ce contenu est protégé par le droit d'auteur. Toute reproduction à l'extérieur des forums Alloprof est interdite et pourra être considérée comme une violation du droit d'auteur.

Ce contenu est protégé par le droit d'auteur. Toute reproduction à l'extérieur des forums Alloprof est interdite et pourra être considérée comme une violation du droit d'auteur.
Ce contenu est protégé par le droit d'auteur. Toute reproduction à l'extérieur des forums Alloprof est interdite et pourra être considérée comme une violation du droit d'auteur.

Ce contenu est protégé par le droit d'auteur. Toute reproduction à l'extérieur des forums Alloprof est interdite et pourra être considérée comme une violation du droit d'auteur.

Ce contenu est protégé par le droit d'auteur. Toute reproduction à l'extérieur des forums Alloprof est interdite et pourra être considérée comme une violation du droit d'auteur.

Ce contenu est protégé par le droit d'auteur. Toute reproduction à l'extérieur des forums Alloprof est interdite et pourra être considérée comme une violation du droit d'auteur.

Ce contenu est protégé par le droit d'auteur. Toute reproduction à l'extérieur des forums Alloprof est interdite et pourra être considérée comme une violation du droit d'auteur.

Ce contenu est protégé par le droit d'auteur. Toute reproduction à l'extérieur des forums Alloprof est interdite et pourra être considérée comme une violation du droit d'auteur.
Bonjour
J'ai quelques questions sur les capsules: lorsque je n'ai pas écrit en rouge par-dessus, cela voulait dire que je souhaiterais quelques éclaircissements sur la phrase en tant que tel. Les photos correspondent aux exercices que j'ai eu un peu de difficulté à résoudre. J'aimerais si possible, saisir le lien entre exercices certains avec la théorie; dans cette optique est-ce possible que vous m'éclairez avec un exemple de démarche, s'il vous plait ?
Exemple dans l'exercice 129, je souhaiterai comprendre pourquoi on a inversé la réaction ensuite on a multiplié par 2 ensuite par 3?
Merci, excellente journée à vous
Cordialement,
















Explication d'Alloprof
Cette explication a été donnée par un membre de l'équipe d'Alloprof.
Bonjour Adam,
Merci de faire appel à nos services.
Je vais tenter de répondre à chacune de tes questions.
Pour la question 129, est-ce qu’une mise en situation a été présentée avec le problème? Il est plutôt difficile d’expliquer pourquoi les équations ont été multipliées ou inversées en ayant uniquement la solution. Cependant, les équations sont généralement réorganisées et multipliées afin que chacune des substances se trouve du bon coté de l’équation et en quantité suffisante.
L’énergie associée aux liaisons chimiques varie en fonction des atomes impliqués ainsi que le type de liaison (simple, double ou triple). Par conséquent, comme c’est une caractéristique qui est propre à chacune des molécules, nous ne pouvons pas généraliser. Je t’invite à consulter la fiche suivante afin de prendre connaissance des tableaux indiquant les énergies associées aux liaisons chimiques.
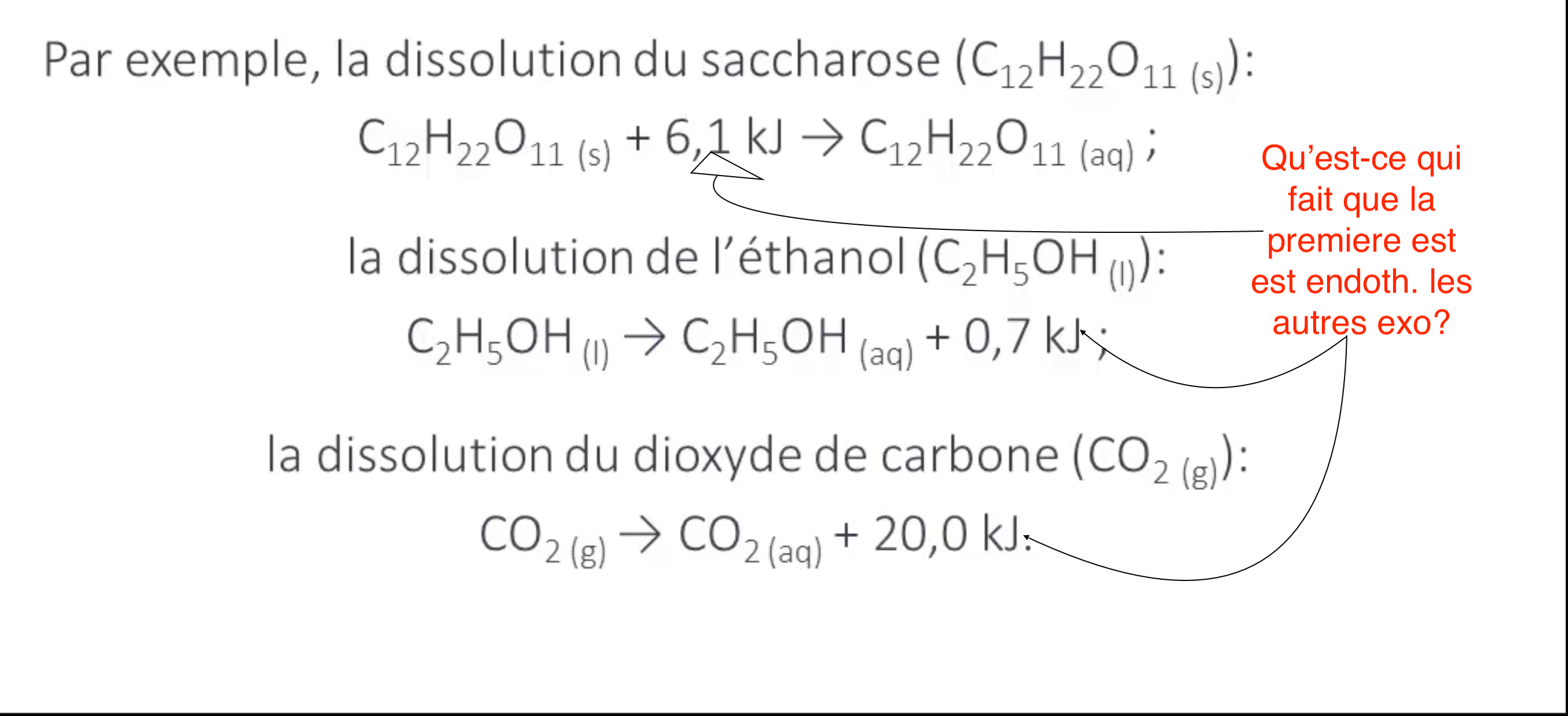
La dissolution est un procédé qui consiste à mettre un soluté dans un solvant dans le but de préparer une solution constituée d’une seule phase (mélange homogène). Par ailleurs, la salvation est un observé lors de la dissolution ionique et elle est caractérisée par l’association de molécules du solvant avec des ions du soluté. Afin de lire davantage au sujet de la dissolution, je t’encourage à lire la fiche ci-dessous.
Ce qui différencie une réaction endothermique d’une réaction exothermique est qu’une réaction endothermique absorbe de l’énergie tandis qu’une réaction exothermique est une transformation de la matière qui dégage de l’énergie. Puis, une réaction endothermique nécessite un apport constant d’énergie alors qu’une réaction exothermique peut nécessiter un apport d’énergie pour être amorcée. Bref, je t’invite à consulter la fiche suivant pour en connaitre davantage au sujet des réactions endothermiques et exothermiques.
La calorimétrie est une méthode expérimentale qui permet de déterminer la chaleur d’une réaction à l’aide de la quantité d’énergie absorbée ou dégagée dans un système isolé, à pression constante. Par conséquent, lorsqu’il s’agit d’une transformation en milieux aqueux, la transformation se fait directement dans l’eau. Alors, comme la température demeure constante, nous pouvons affirmer que la capacité thermique massique de la solution est équivalente à celle de l’eau.
Pour les autres captures d’écrans, je crois que ce sont toutes des questions concernant la loi de Hess. Par conséquent, je t’invite à consulter la fiche suivante. De plus, je tiens à te souligner que Hess a remarqué que la variation d'enthalpie d'une réaction est la même, que cette réaction se déroule en une ou en plusieurs étapes. Ainsi, la variation ne dépend que des réactifs et des produits et est indépendante du mécanisme de la réaction et du nombre d'étapes intermédiaires nécessaires au déroulement de la réaction complète. De plus, je t’encourage à porter un regard attentif aux exemples de la fiche. Ces derniers montrent bien comment procéder pour déterminer la chaleur d’une réaction.
En espérant que ma réponse t’aide un petit peu :).
N’hésite pas à nous réécrire si tu as d’autres questions.
Émilie
Suggestions en lien avec la question
Suggestion en lien avec la question
Voici ce qui a été trouvé automatiquement sur le site, en espérant que ça t’aide!