Secondaire 5 • 11m
Bonjour !
En chimie sec 5,
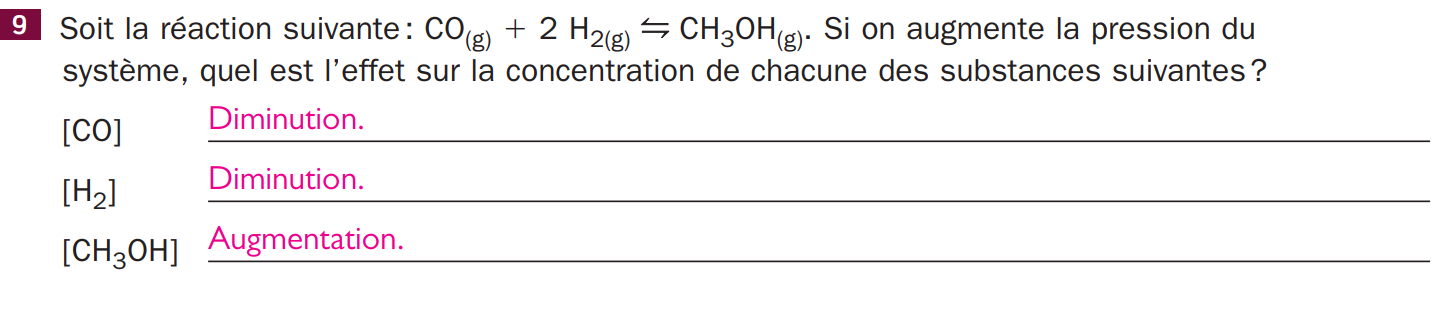
je ne comprends pas pourquoi c'est une reaction directe quand la pression augmente, car les produits et reactifs ont le meme nombre de mol, alors pourquoi la reaction favorise les produits ?
Merci!






Explication d'Alloprof
Cette explication a été donnée par un membre de l'équipe d'Alloprof.
Bonjour SaturneSigma,
Merci pour ta question!
Lorsque l'on modifie la pression d'un système réactionnel, la réaction à l'équilibre tend à s'opposer à cette modification.
Dans le cas de ton problème, les produits représentent un plus petit nombre de molécules que les réactifs (1 contre 2). Ainsi, dans le cas d'une augmentation de pression, la production de produits sera favorisée.
N'hésite pas si tu as encore besoin d'aide:)
Kylan
Suggestions en lien avec la question
Suggestion en lien avec la question
Voici ce qui a été trouvé automatiquement sur le site, en espérant que ça t’aide!