Secondaire 5 • 3m
Salut
Ici j ai quelques questions...
Si l'on veut démontrer la loi de dalton ici
on dit que le contenant est a TPN , donc la Pt=101.3kPa
La Pp de chacun des gaz peut etre determiner avec les donnees fournies (nT et n de chacun des gaz)
et si on additionne la Pp de chacun de gaz on obtient 101.3kPa...
et on sait que chaque gaz agit comme s'il etait seul a occuper tout l'espace disponible , donc ils ont tous le meme volume ... alors pourquoi quand on fait la loi des gaz parfait on obtient qu'ils ont des volumes différents
je sais qu'ici c est pas un exercice ou il faut appliquer la loi de dalton , mais j ai pense a ca ici
le corrige
j ai trouve la reponse juste j ai bloque sur l application de la loi de dalton sur l exercice merci :)
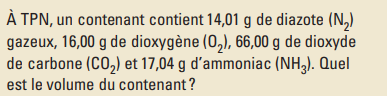








Explication d'Alloprof
Cette explication a été donnée par un membre de l'équipe d'Alloprof.
Salut :D
La loi des pressions partielles (théorisée par Dalton) stipule que, à une température donnée, la pression totale d'un mélange gazeux est égale à la somme des pressions partielles exercées par chacun des gaz composant le mélange.
Cela correspond exactement au contexte de ton problème, le nombre de moles de chacun des gaz est relié à son volume (les volumes s'additionnent pour donner le volume total) et à sa pression partielle.
Ce contenu est protégé par le droit d'auteur. Toute reproduction à l'extérieur des forums Alloprof est interdite et pourra être considérée comme une violation du droit d'auteur.
On la modifie pour qu'elle s'exprime en fonction des volumes à l'aide de la loi des gaz parfaits PV = nRT.
N'hésite pas si tu as d'autres questions :D À bientôt :)
Suggestions en lien avec la question
Suggestion en lien avec la question
Voici ce qui a été trouvé automatiquement sur le site, en espérant que ça t’aide!