Secondaire 5 • 3m
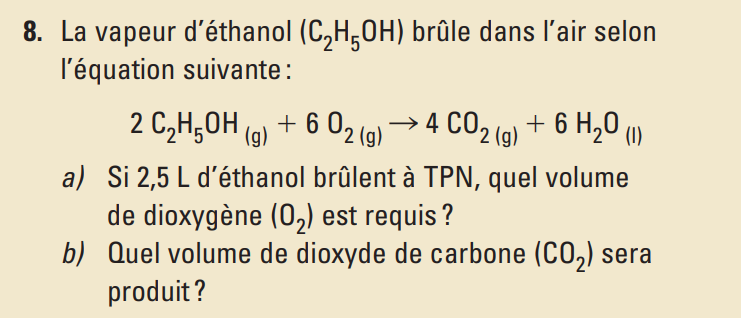
pour le b ici comment je vais savoir que la pression de 101.3kPa est restée la meme dans les produits aussi , parce que moi j'aurai fait la loi de P/n=P/n pour trouver la P des produits et ensuite faire le produit croise
(2.5L C2H5OHx4molCO2 ) / 2 mol C2H5OH = Volume de CO2 ...?!?
thx






Explication d'Alloprof
Cette explication a été donnée par un membre de l'équipe d'Alloprof.
Bonjour TitanAlpha,
Merci pour ta question!
Dans ce cas, l'éthanol brûle dans l'air, donc dans un milieu ouvert. La réaction n'a pas un effet suffisant pour changer la pression ambiante de l'air (puisqu'il ne s'agit pas d'un milieu fermé). Tu peux donc encore considérer que la pression après la réaction est de 101,3 kPa.
N'hésite pas si tu as encore besoin d'aide:)
Kylan
Suggestions en lien avec la question
Suggestion en lien avec la question
Voici ce qui a été trouvé automatiquement sur le site, en espérant que ça t’aide!