Secondaire 5 • 2m
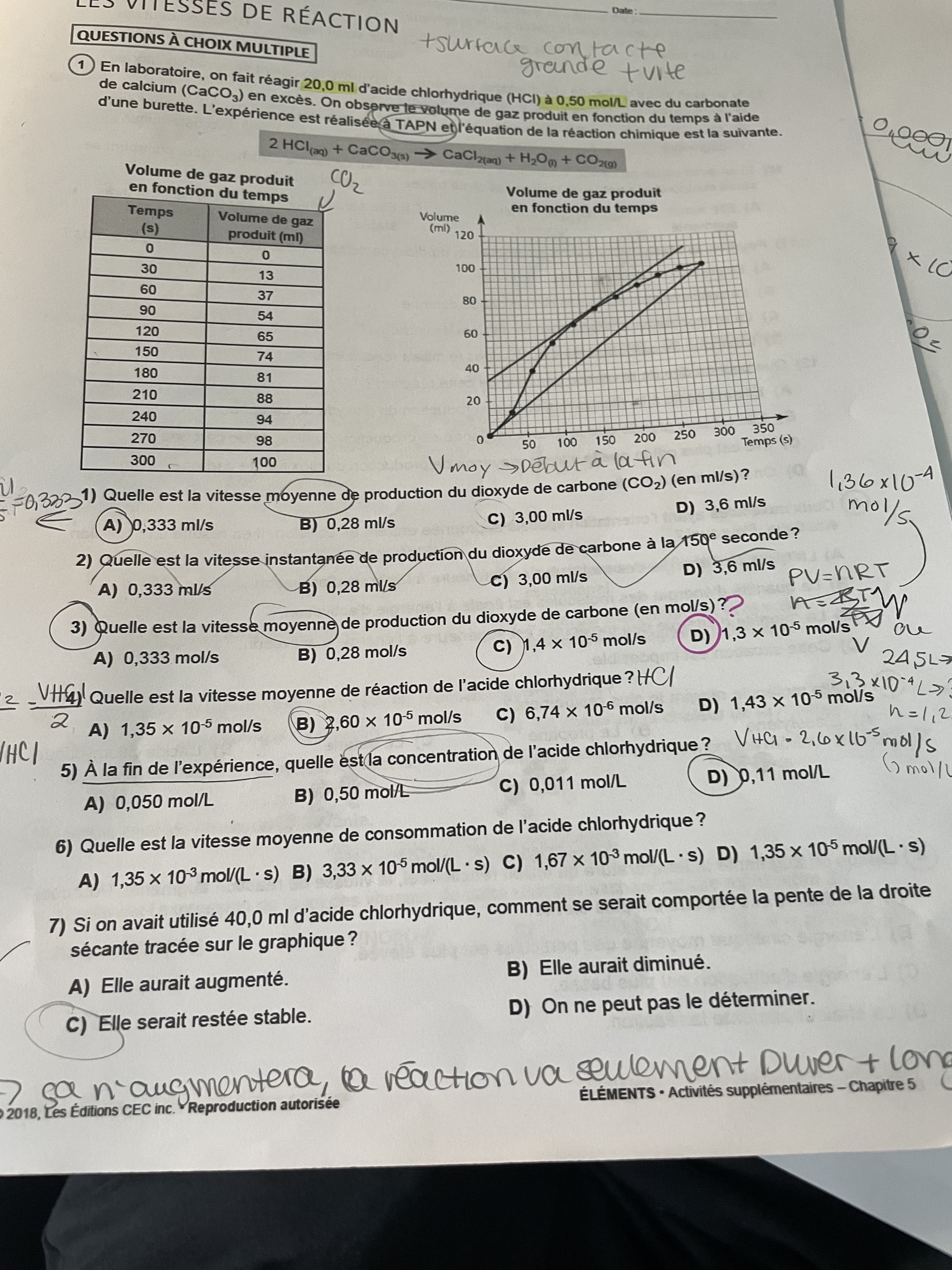
Bonjour, je me demandais, au numero 5, on demande la concentration finale de l’acide chlorhydrique qui est au départ à 0,50 mol/L pour un volume de 20ml comment pouvons nous arriver à 0,11mol/L? Je connais sa vitesse moyenne qui est de 2,60x10^-5 mol/s. Je ne sais pas quoi faire quand on me demande la concentration FINALE?








Explication d'Alloprof
Cette explication a été donnée par un membre de l'équipe d'Alloprof.
Salut AvocatChouette1853,
Merci pour ta question!
Pour cette question, ce que je te recommande est d'utiliser la loi des gaz parfaits et la stœchiométrie. D'abord, tu peux estimer le nombre final de mol de CO2 à l'aide de la loi des gaz parfaits. À l'aide de ce nombre de mol, tu peux trouver le nombre de mol de HCl ayant réagi par stœchiométrie. Le volume de HCl est resté le même, tu peux trouver sa concentration finale en divisant le nombre de mol final de HCl par le volume de HCl.
Voici notre fiche sur la stœchiométrie si tu veux en savoir plus :
J'espère que ça t'aide et n'hésite pas à nous réécrire si tu as d'autres questions!
Anthony B.
Suggestions en lien avec la question
Suggestion en lien avec la question
Voici ce qui a été trouvé automatiquement sur le site, en espérant que ça t’aide!