Secondary V • 10mo.
Pourquoi, dans le corriger, ils ont mis le delta T en -90,3 KJ, alors que le NO est dans les réactifs (donc, son signe censé être positif/endothermique), et l'autre delta T en +33,2 KJ alors que le NO2 est dans les produits (donc, son signe est censé être négatif/exothermique) ?
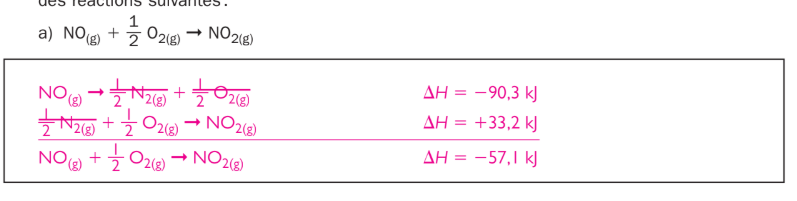





Explanation from Alloprof
This Explanation was submitted by a member of the Alloprof team.
Salut !
L'enthalpie dépend de la direction de la réaction.
$$ \frac{1}{2}N_2+\frac{1}{2}O_2\rightarrow NO\Rightarrow \Delta H=+90,3kJ $$
Donc,
$$ NO\rightarrow \frac{1}{2}N_2+\frac{1}{2}O_2 \Rightarrow \Delta H=-90,3kJ $$
Le signe ne dépend pas du côté auquel se trouve un produit, mais plutôt à la direction de la réaction selon son enthalpie.
J'espère que cela ait pu t'aider et si tu as d'autres questions, n'hésite pas !
Bonne soirée !