Bonjour!
J'avais plusieurs questions en matière des liaisons ioniques et covalentes.
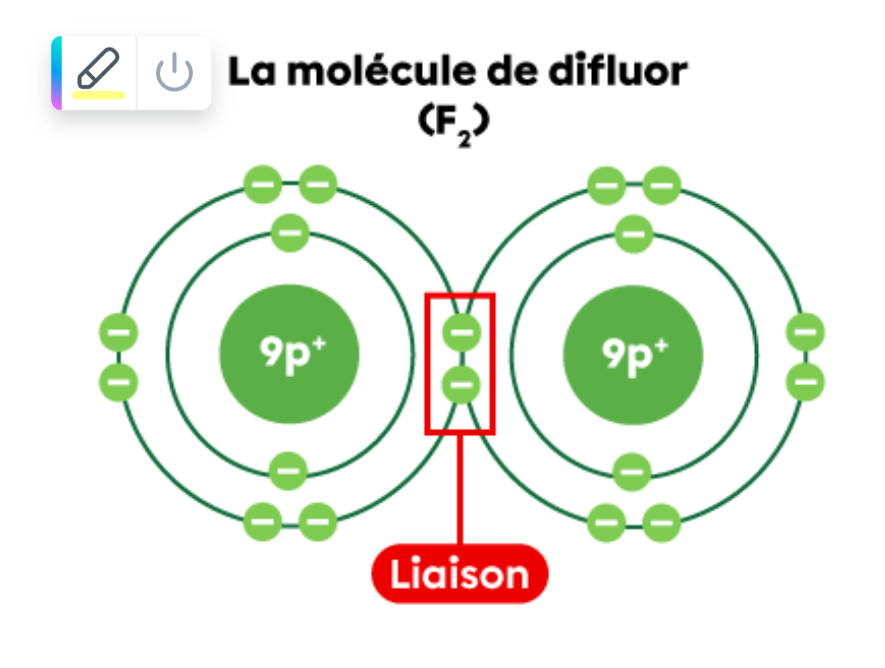
1) Si nous avons un composé moléculaire, soit F2 (difluorure), lorsque les deux atomes de fluor vont partager leurs électrons, est-ce qu'ils agissent comme des ions?
Dans cette image, lorsqu'on compte le nombre d'électrons après la liaison covalente, on va dire que le fluor a 10 électrons donc une couche périph, non? Donc, peut-on dire que ce sont deux ions de fluor?
2) Si les deux atomes de fluor se sentent parfaits et partagent des électrons, ils agissent comme des ions, non? Donc, pourquoi les deux charges négatives ne se repoussent pas? (F- et F-) ?
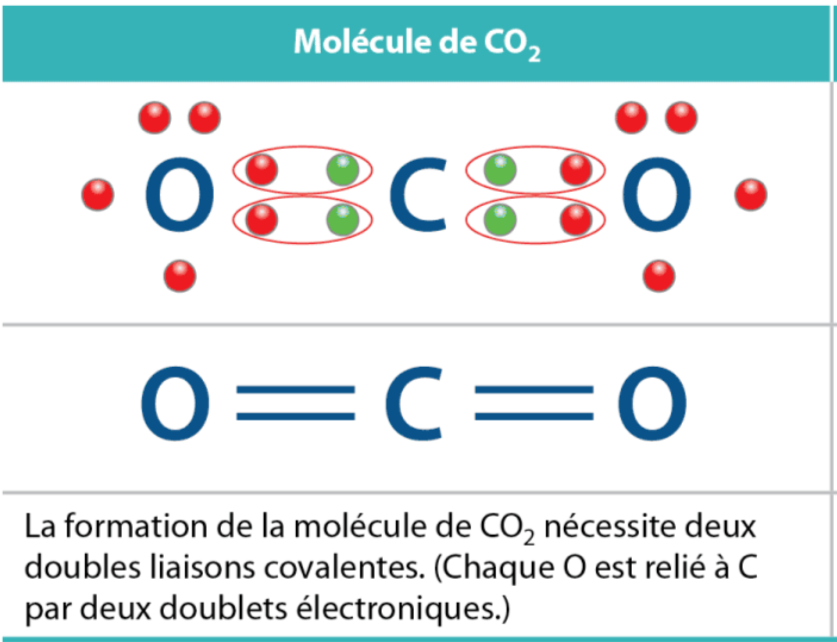
3) Dans l'image ci-contre, je ne comprends pas pourquoi les électrons de valence du Carbone sont représentés en doublets avec la Notation de Lewis (normalement, on est supossé d'avoir les 4 électrons de valence autour de C):
J'ai beaucoup de difficultés en chimie. S.v.p aidez-moi :(
Merci !





Explanation from Alloprof
This Explanation was submitted by a member of the Alloprof team.
Salut :D
1) Lorsque deux atomes partagent leurs électrons, ils deviennent une molécule chimiquement stables. Ils n'agissent pas comme des ions.
2) L'illustration permet de mettre en lumière le fait que les électrons sont partagés. En réalité, ils gravitent sur des couches électroniques, ils ne sont donc pas côte à côte de cette manière.
3) C'est exact, c'est probablement pour simplifier le schéma.
N'hésite pas si tu as d'autres questions :D À bientôt :)