Secondaire 5 • 7m
Bonjour,
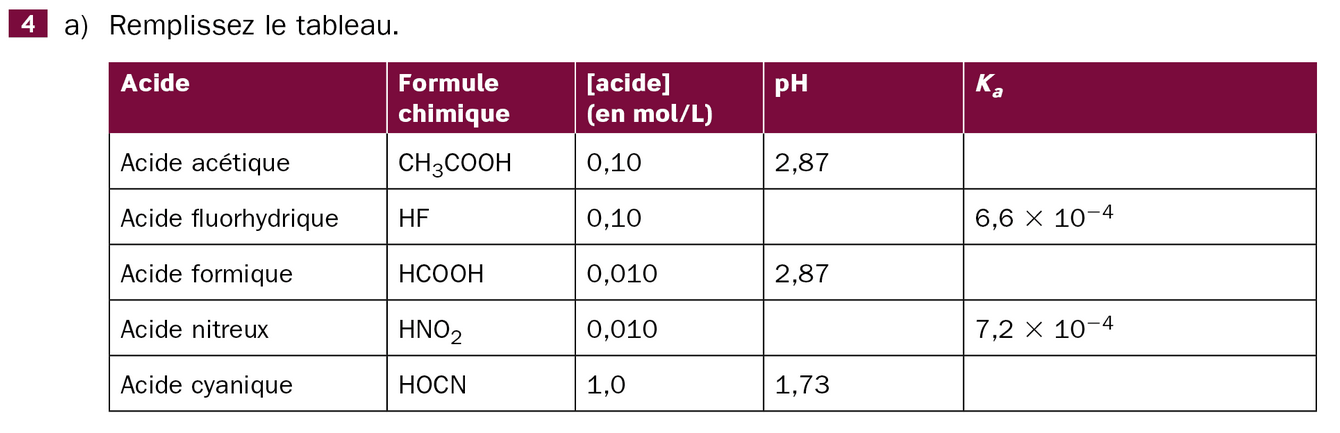
Je suis en train d'étudier les acides et les bases, et j'ai quelques difficultés à comprendre comment calculer le pH et la constante d'acidité des acides de ce tableau.
Pourriez-vous m'expliquer la méthode à suivre ?
Merci d'avance pour votre aide !






Explication vérifiée par Alloprof
Cette explication a été vérifiée par un membre de l’équipe d’Alloprof.
Bonjour!
Voici une explication plus simple pour t’aider à comprendre comment remplir le tableau :
Ce que tu dois savoir :
Étapes simples pour calculer Ka :
[H⁺] = 10^(-pH)
Par exemple, si le pH est 2,87 :
[H⁺] = 10^(-2,87) ≈ 1,35 × 10⁻³
Ka = ([H⁺])² / [acide initial]
Tu prends la valeur de [H⁺] trouvée à l’étape 1, tu la mets au carré, puis tu divises par la concentration de l’acide.
Exemple avec l’acide acétique (concentration 0,10 mol/L, pH 2,87) :
[H⁺] = 10^(-2,87) ≈ 1,35 × 10⁻³
Ka = (1,35 × 10⁻³)² / 0,10 ≈ 1,8 × 10⁻⁵
Résumé :
Est-ce que cela t'a été utile ?
Suggestions en lien avec la question
Suggestion en lien avec la question
Voici ce qui a été trouvé automatiquement sur le site, en espérant que ça t’aide!