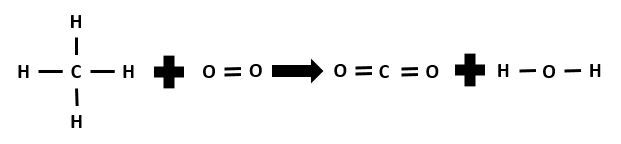Matières
Niveaux
Le bilan énergétique d'une transformation établit la somme d'énergie nécessaire pour briser les liaisons chimiques des réactifs et d'énergie dégagée au moment de la formation des liaisons des produits.
Le bilan d'une réaction chimique vise à permettre de déterminer la variation d'enthalpie d'une réaction chimique. Pour ce faire, différentes façons sont possibles.
Toute réaction chimique comprend le bris de liaisons chimiques et la formation de nouvelles liaisons chimiques. Le bris de liens chimiques nécessite toujours un apport d'énergie (énergie positive) alors que leur formation s'accompagne d'une libération d'énergie (énergie négative). En additionnant l'énergie servant aux ruptures et celle nécessaire aux formations de liaisons, on peut déterminer si une réaction est exothermique ou endothermique, et ainsi établir son bilan énergétique.
|\text{Bilan énergétique = Énergie absorbée + Énergie dégagée}|
Conséquemment, pour déterminer la variation d'enthalpie globale d'une réaction, il suffit de faire la somme de la variation d'enthalpie associée au bris des liaisons des réactions avec celle associée à la formation des liaisons des produits. On peut représenter ce calcul pour la formule suivante:
|ΔH = ΔH_{\text{réactifs}} + ΔH_{\text{produits}}|
À noter: les valeurs des variations d'enthalpie sont exprimées en |\small \text {kJ/mol}|.
Afin de dresser le bilan énergétique d'une réaction, il faut d'abord bien observer chacune des substances en jeu afin de bien cerner les types de liaisons impliquées. Chaque type de liaison possède une énergie de liaison qui lui est propre. L'énergie de liaison correspond à l'énergie nécessaire pour la briser, ou à l'énergie dégagée lorsqu'elle se forme. Le lien ci-dessous donne les valeurs d'énergie de liaison les plus communes.
On peut suivre les étapes suivantes pour dresser le bilan énergétique d'une réaction:
Il est à noter que si la liaison est du côté des réactifs, son signe sera positif. Si la liaison est du côté des produits, le signe sera alors négatif.
Calculez la variation d'enthalpie de cette réaction en faisant le bilan énergétique et déterminez s'il s'agit d'une réaction endothermique ou exothermique.
|CH_{4(g)} + 2\:O_{2(g)} \rightarrow CO_{2(g)} + 2\: H_{2}O_{(g)}|