Matières
Niveaux
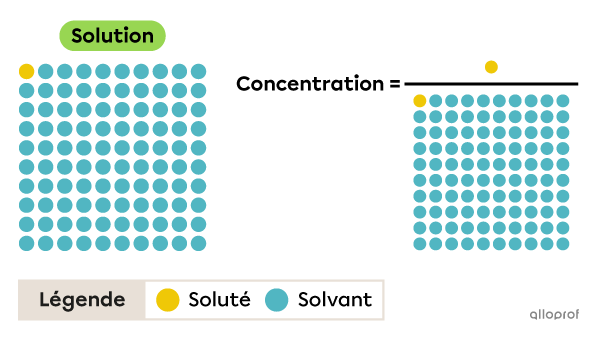
La concentration d’une solution correspond au rapport entre la quantité de soluté dissoute et la quantité de solution.
Il ne faut pas confondre la quantité de solvant et la quantité de solution.
Par exemple, pour exprimer la concentration de la solution représentée dans cette image, on dit qu’il y a 1 partie de soluté dans 100 parties de solution, et non 1 partie de soluté dans 99 parties de solvant.
La concentration d’une solution est influencée par différents facteurs et peut s’exprimer à l’aide d’unités diverses.

Moments dans la vidéo :
On peut calculer la concentration à l’aide de cette formule générale.
||C = \dfrac{Q_{soluté}}{Q_{solution}}||
où
|C\ :| concentration
|Q_{soluté}\ :| quantité de soluté
|Q_{solution}\ :| quantité de solution
En considérant cette formule, on comprend que modifier la quantité de soluté ou la quantité de solution a une influence sur la concentration d’une solution. Pour modifier la quantité de solution de façon significative, on modifie généralement la quantité de solvant.
Le tableau suivant résume l’effet de différents facteurs sur la concentration.
| Modification apportée à la solution | Conséquence sur la concentration | Exemple |
|---|---|---|
| |\color{#7CCA51}{\nearrow}| Augmentation de la quantité de solvant | |\color{#EC0000}{\searrow}| Diminution de la concentration | Procéder à la dilution d’une solution. |
| |\color{#EC0000}{\searrow}| Diminution de la quantité de solvant | |\color{#7CCA51}{\nearrow}| Augmentation de la concentration | Procéder à l’évaporation du solvant d’une solution. |
| |\color{#7CCA51}{\nearrow}| Augmentation de la quantité de soluté | |\color{#7CCA51}{\nearrow}| Augmentation de la concentration | Procéder à la dissolution de davantage de soluté dans une solution. |
| |\color{#EC0000}{\searrow}| Diminution de la quantité de soluté | |\color{#EC0000}{\searrow}| Diminution de la concentration | Procéder à l’évaporation d’un soluté volatil (qui s’évapore facilement) dans une solution. |
Il existe plusieurs types de concentration, chacun s’exprimant à l’aide d’unités différentes. En voici quelques-uns :
la concentration massique volumique |(\text{g/L})| — Secondaire 3;
la concentration en pourcentage |(\text{%})| — Secondaire 3;
la concentration en parties par million |(\text{ppm})| — Secondaire 4 — ST;
la concentration molaire ou molarité |(\text{mol/L})| — Secondaire 4 — STE.