Secondaire 5 • 2a
La synthèse de l'ammoniac obéit à la réaction suivante :
N2(g) + 3H2(g) → 2 NH3(g)
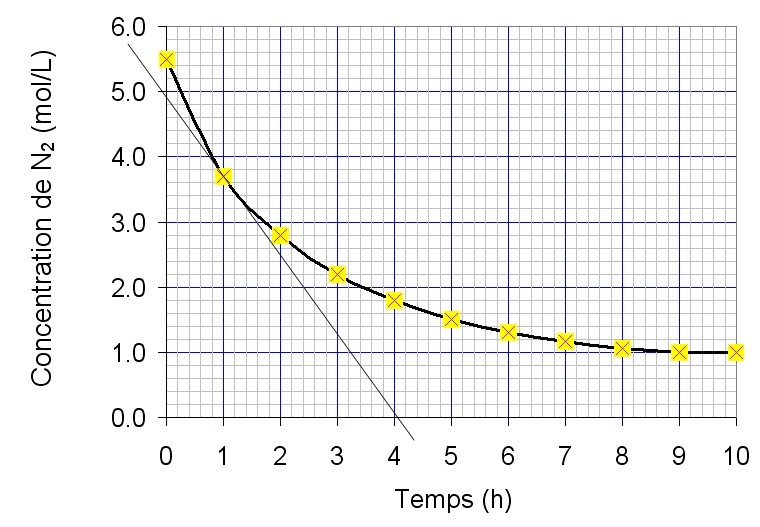
Des mesures de la concentration de N2(g) ont été prises à différents moments et portées en graphique.
(La tangente (droite) à la courbe n'est pas utile pour répondre aux questions).
Quelle est la vitesse moyenne de formation du NH3(g) entre 0 et 3 heures.
Attention, le graphique est en "heure" et on veut une vitesse en "mol/L·s".
Quelle est la vitesse générale de la réaction entre 0 et 3 heures.






Explication d'Alloprof
Cette explication a été donnée par un membre de l'équipe d'Alloprof.
Merci pour ta question!
Pour y répondre, il faut trouver la vitesse de diminution de la concentration de N2 :
$$ v = \frac{∆[N_2]}{∆t} $$
Légende :
• v : vitesse ((mol/L)/h)
• ∆[N2] : variation de la concentration de N2
• ∆t : variation du temps
En remplaceant les variables de l'équation par leurs variables correspondantes, on trouve :
$$ v = \frac{2,2-5,5}{3-0} = 1,1\:\frac{\frac{moles}{L}}{h} $$
Par la suite, il ne reste qu'à convertir la vitesse dans l'unité appropriée. Pour ce faire, rappelle toi qu'il y a 60 minutes • 60 secondes = 3600 secondes dans une heure. Je te laisse faire le calcul pour compléter le problème 😉
Cette fiche du site d'Alloprof explique la vitesse de réaction :
N'hésite pas si tu as d'autres questions!
Suggestions en lien avec la question
Suggestion en lien avec la question
Voici ce qui a été trouvé automatiquement sur le site, en espérant que ça t’aide!