Matières
Niveaux
Cette fiche explique les manipulations à suivre pour déterminer si une substance est de nature acide, basique ou neutre.
Il existe quatre façons de déterminer la nature d'une substance.
Si la solution est sous forme solide, il faut la dissoudre dans un peu d'eau distillée (eau pure) avant de procéder à ces tests.
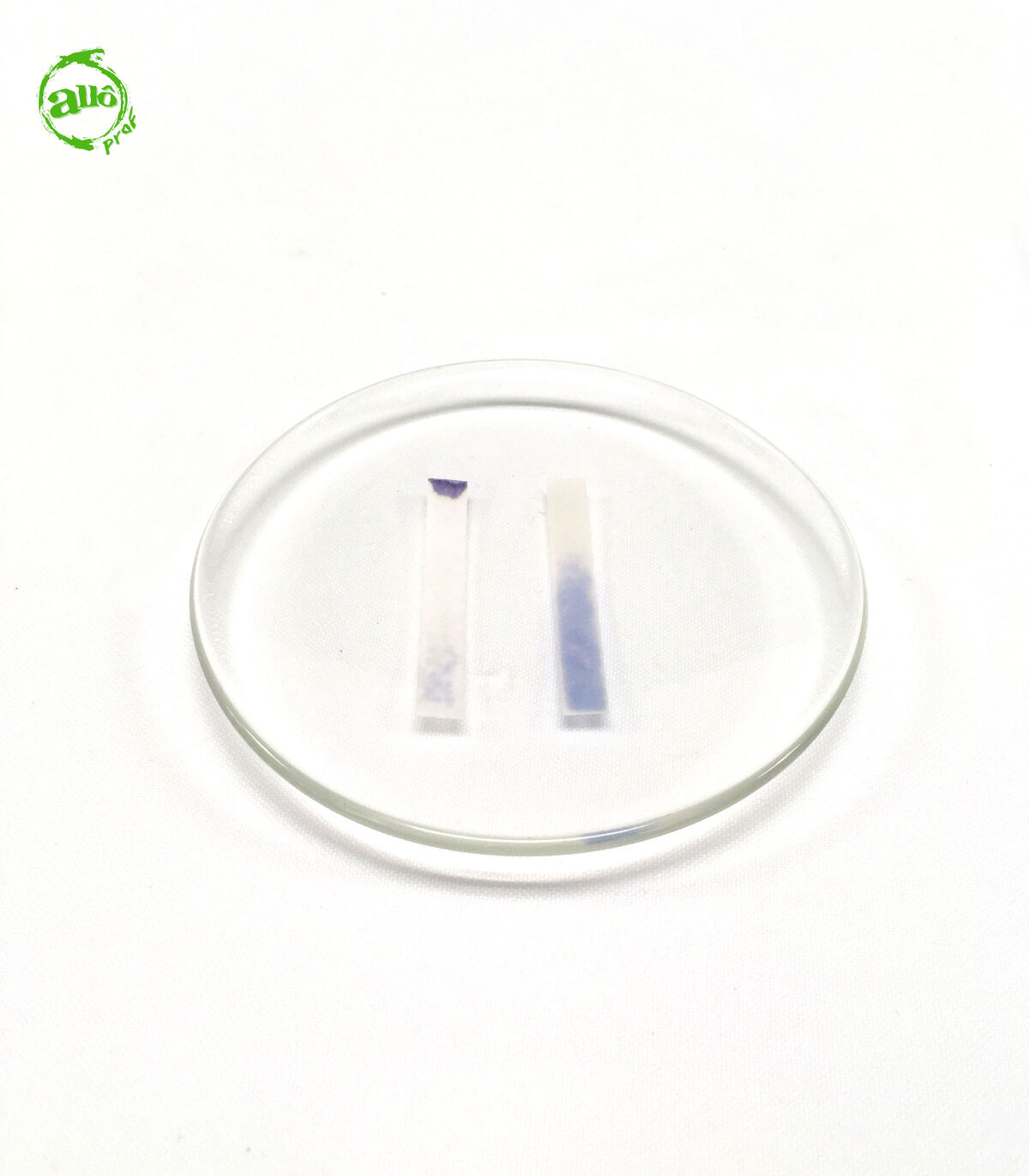
Le papier tournesol est imbibé de teinture de tournesol ou d'extrait de poudre de lichen. Il sert d'indicateur coloré pour déterminer la nature acide, basique ou neutre d'une solution. Toutefois, il ne permet pas de connaître avec précision la valeur du pH.


1. Prendre une languette de papier tournesol avec une pince brucelle.

2. Tremper l'extrémité libre du papier tournesol dans le liquide inconnu.

Il n'est pas utile de tremper complètement le papier tournesol dans le liquide. Puisque le papier est maintenu par la pince brucelle, cette dernière pourrait être contaminée si elle est trempée dans le liquide. Si la pince entre en contact avec le liquide, il faut la laver avant de la réutiliser.
De plus, il ne faut pas prendre le papier tournesol avec ses mains pour le tremper dans le liquide. Puisque la nature de la substance est inconnue, il peut être dangereux de tremper ses doigts dans certains liquides. Il est donc préférable de travailler en tout temps avec des pinces brucelles.
3. Observer la couleur du papier tournesol.

4. Jeter les papiers tournesol utilisés et nettoyer le matériel.
Dans certains contextes, pour éviter des contaminations croisées, il est préférable d'utiliser un compte-gouttes pour faire le test du papier tournesol. Il suffit de prélever quelques gouttes de la solution dont la nature est inconnue et de les déposer sur un morceau de papier tournesol placé dans un verre de montre.

Dépendamment de la couleur du papier tournesol utilisé au départ, différents résultats peuvent être obtenus.



Il existe un papier tournesol violet qui permet de remplacer les papiers tournesol rouge et bleu. Ce papier permet de faire les deux tests en une seule étape. L'analyse des résultats obtenus se fait de la même façon.

Certaines substances, comme celles qui contiennent du chlore, peuvent blanchir le papier tournesol. Il n'est donc pas possible d'identifier la nature de ces solutions avec le papier tournesol.

Le papier pH est en fait un papier imbibé d’un indicateur universel, qui est un mélange d'indicateurs. Lorsque l’on trempe un morceau de papier pH dans une solution, le papier change de couleur en fonction du pH du milieu. Le papier pH est donc plus précis que le papier tournesol pour identifier la nature de la solution, car il permet d'établir un niveau d'acidité ou de basicité.


1. Prendre une languette de papier pH avec une pince brucelle.
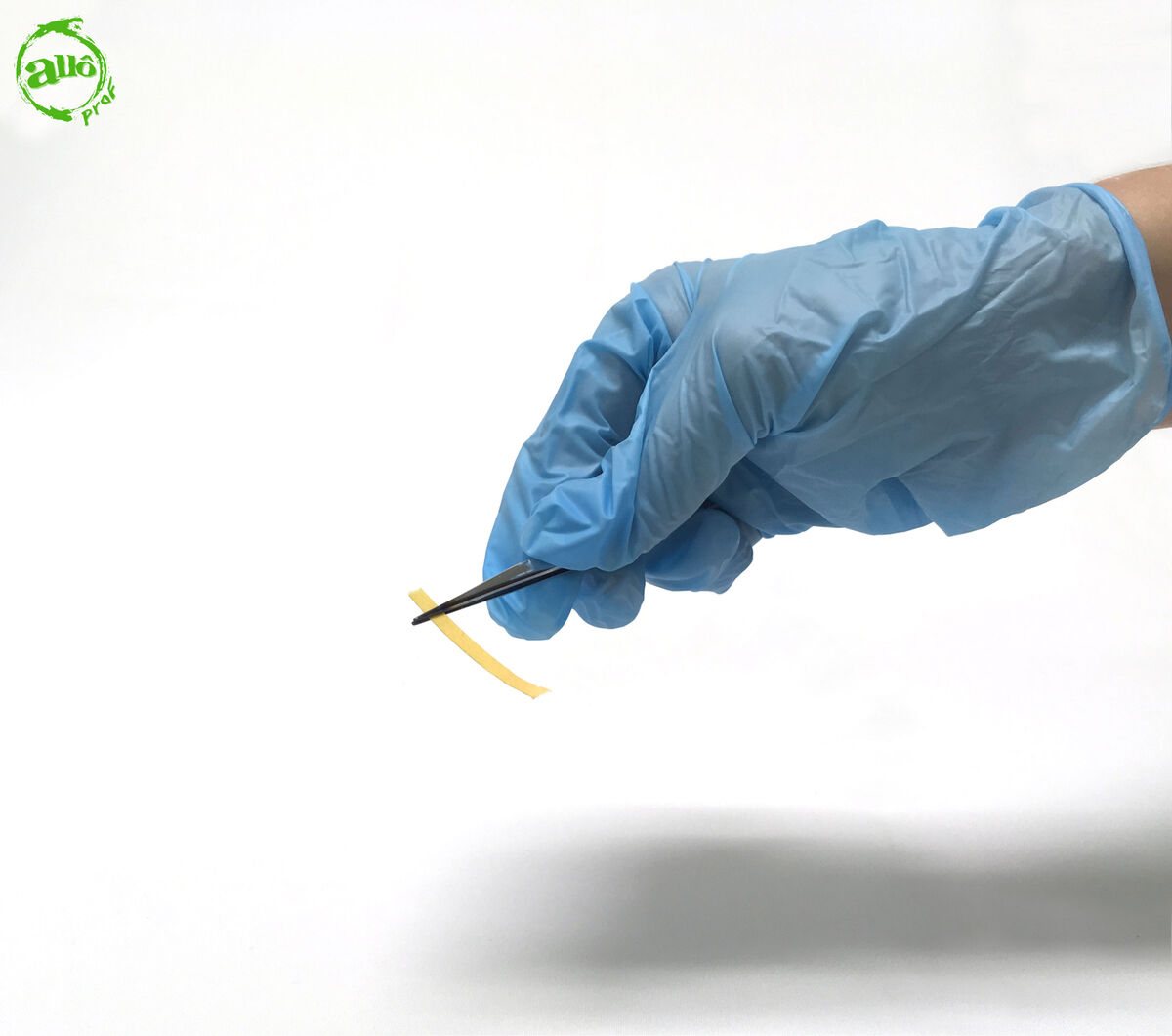
2. Tremper l'extrémité libre du papier pH dans le liquide inconnu.

Il n'est pas utile de tremper complètement le papier pH dans le liquide. Puisque le papier est maintenu par la pince brucelle, cette dernière pourrait être contaminée si elle est trempée dans le liquide. Si la pince entre en contact avec le liquide, il faut la laver avant de la réutiliser.
De plus, il ne faut pas prendre le papier pH avec ses mains pour le tremper dans le liquide. Puisque la nature de la substance est inconnue, il peut être dangereux de tremper ses doigts dans certains liquides. Il est donc préférable de travailler en tout temps avec des pinces brucelles.
3. Comparer la couleur du papier pH avec l'étalon universel fourni par le fabricant.
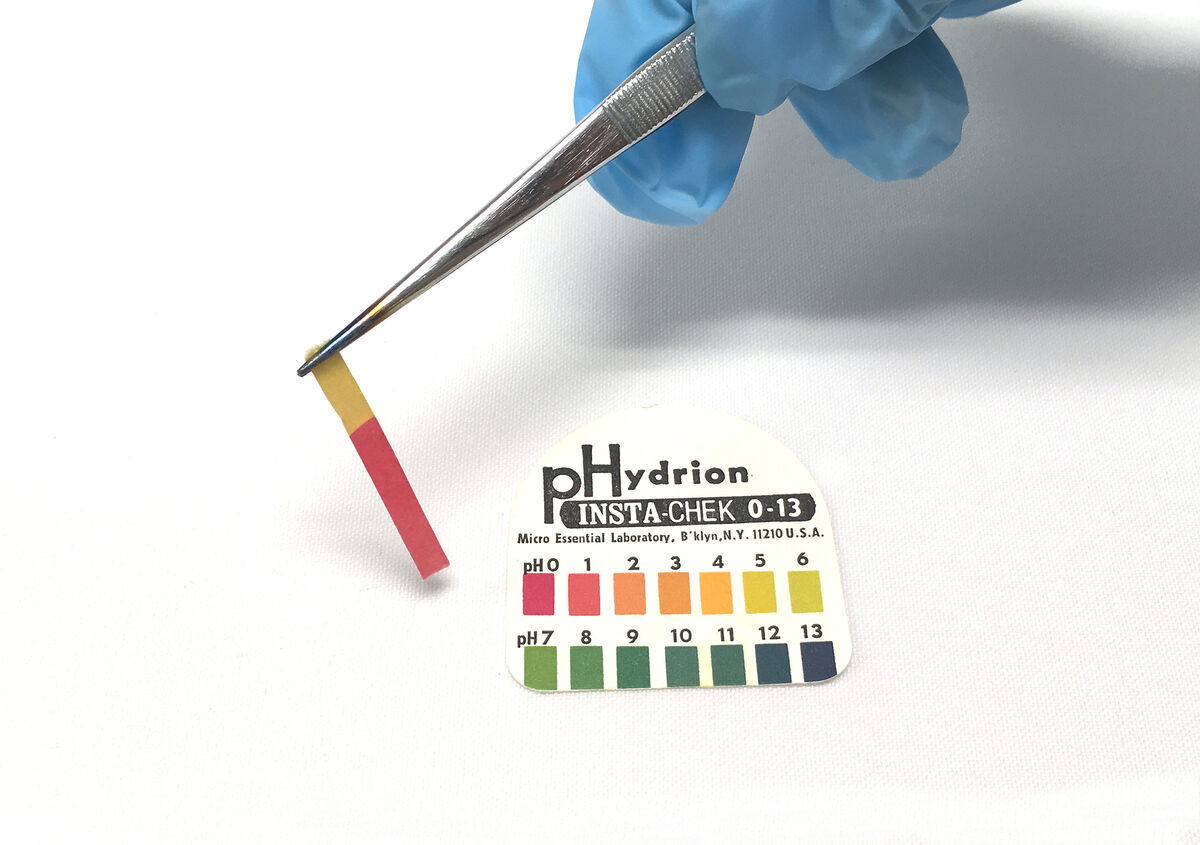
4. Jeter le papier pH utilisé et nettoyer le matériel.
Dans certains contextes, pour éviter des contaminations croisées, il est préférable d'utiliser un compte-gouttes pour faire le test du papier pH. Il suffit de prélever quelques gouttes de la solution dont la nature est inconnue et de les déposer sur un morceau de papier pH placé dans un verre de montre.

Lors de la comparaison entre le papier pH coloré et l'étalon fourni, la valeur du pH de la solution pourra être identifiée. Selon cette valeur, la nature de la substance pourra être déterminée.
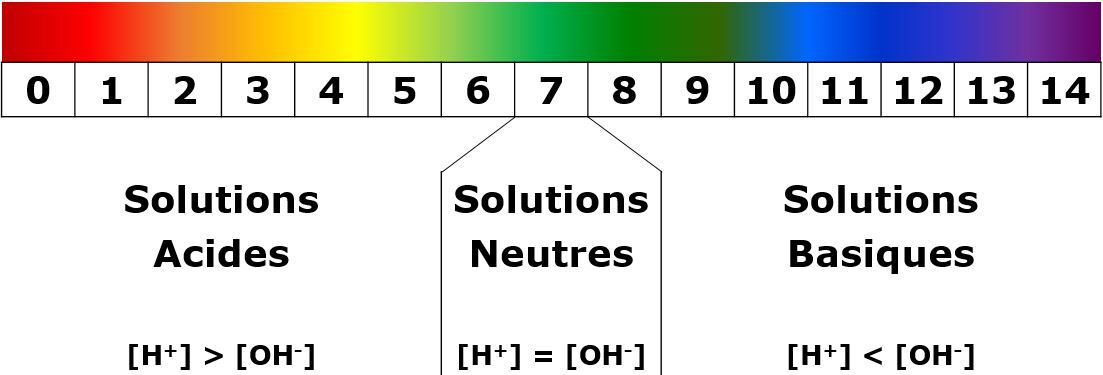
Les couleurs fournies dans l'image ci-dessus sont données à titre indicatif.
Les indicateurs acidobasiques sont des substances qui changent de couleur en fonction du pH d’une solution. Chacun de ces indicateurs permet de donner un intervalle de pH selon la couleur obtenue lorsque l'indicateur est mélangé avec la solution.

Les indicateurs acidobasiques sont souvent utilisés en laboratoire durant une neutralisation acidobasique.

1. Verser quelques gouttes d'indicateur acidobasique à l'aide du compte-gouttes dans la solution à identifier.

2. Mettre le bouchon de caoutchouc sur l'éprouvette.

3. Brasser la solution.

4. Comparer la couleur de la solution avec les couleurs connues du point de virage.

5. Jeter la solution selon les normes exigées.
Pour déterminer le pH de la solution, il faut connaître sa zone de virage. Pour le bleu de bromothymol, la zone de virage est la suivante.
| Point de virage | Teinte acide | Teinte basique | |
| Bleu de bromothymol | 6,0 – 7,6 | Jaune | Bleu |
Dans ce contexte, on peut donc déduire que:
Dans l'exemple montré ci-dessus, la solution est basique (pH entre 7,6 et 14).
Le pH-mètre est un appareil électronique permettant de déterminer le pH d’une solution. Il existe de nombreux modèles de pH-mètres. Cependant, ils ont tous le même principe de fonctionnement: un pH-mètre est constitué de deux électrodes, l'une standard appelée électrode de référence, et une autre qui varie en fonction du pH, appelée électrode de verre. Ces deux électrodes peuvent être combinées ou séparées.


1. Allumer l'appareil.

2. Rincer l'électrode avec de l'eau distillée.

3. Calibrer le pH-mètre en trempant l'électrode dans une substance dont le pH est connu (solution étalon).

4. Sortir l'électrode de la solution étalon et la rincer à nouveau avec de l'eau distillée.

5. Tremper l'électrode dans la solution à identifier.

6. Lire la mesure du pH.

7. Sortir l'électrode de la solution à identifier et la rincer à nouveau avec de l'eau distillée.

L'avantage du pH-mètre est de donner une mesure directe de la nature de la substance. Dans notre exemple, la nature de la substance est acide, car la valeur du pH indiquée par le pH-mètre est inférieure à 7.