Matières
Niveaux
En solution dans l’eau, un électrolyte se dissocie en deux ions, soit un ion positif appelé cation et un ion négatif appelé anion. Les ions obtenus par la dissociation de l’électrolyte peuvent conduire un courant électrique dans la solution aqueuse.
Les acides, les bases et les sels sont des électrolytes.
Un électrolyte est une substance qui permet le passage du courant lorsqu’elle est en solution aqueuse.
Un non-électrolyte est une substance qui ne permet pas le passage du courant électrique lorsqu’elle est en solution aqueuse.
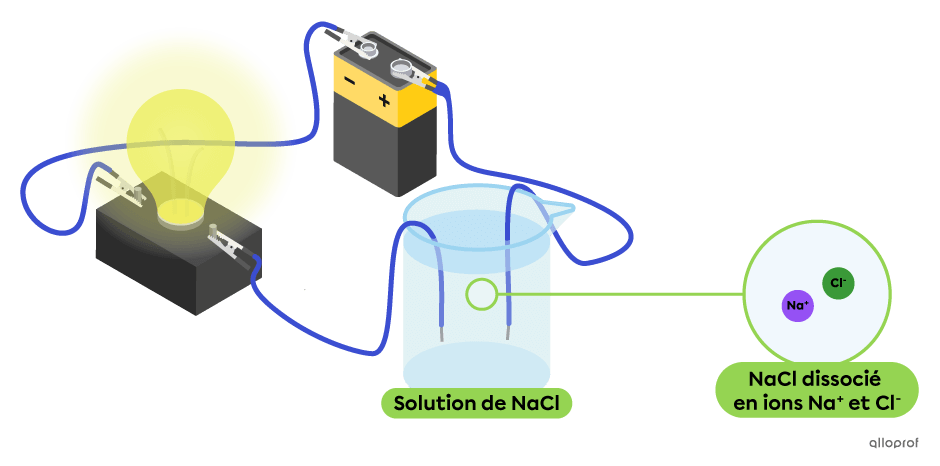
Dans le montage suivant, la solution aqueuse de chlorure de sodium |(\text{NaCl}),| un sel, contient des ions |\text{Na}^+| et |\text{Cl}^-.| On observe que cette solution conduit le courant électrique, puisque l’ampoule est allumée. Le chlorure de sodium |(\text{NaCl})| est bien un électrolyte.
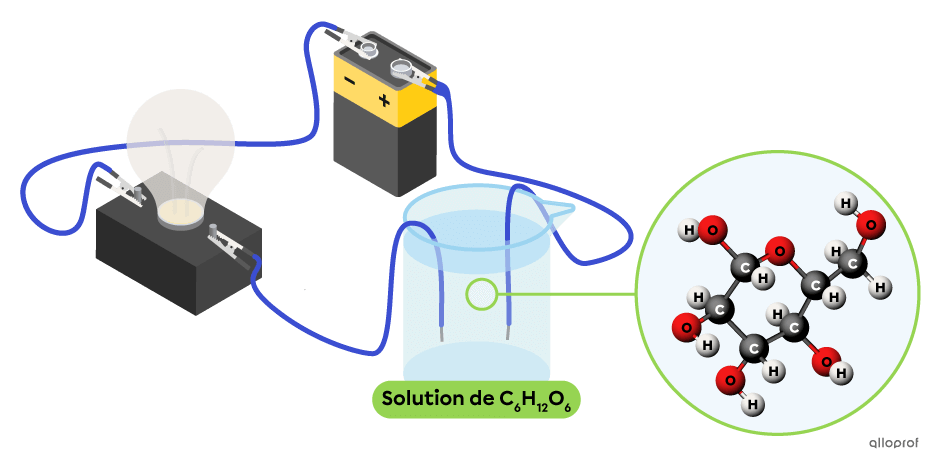
Le glucose |(\text{C}{_6}\text{H}{_{12}}\text{O}{_6}),| le dioxygène |(\text{O}{_2})| et le dioxyde de carbone |(\text{CO}{_2})| sont des exemples de non-électrolytes.
Dans le montage suivant, la solution aqueuse de glucose |(\text{C}{_6}\text{H}{_{12}}\text{O}{_6})| ne contient pas d’ions. On observe que cette solution ne conduit pas le courant électrique, puisque l’ampoule est éteinte. Le glucose |(\text{C}{_6}\text{H}{_{12}}\text{O}{_6})| est bien un non-électrolyte.
Voici quelques généralités étudiées en 4e secondaire concernant les acides, les bases et les sels.
| Type d’électrolyte | Acide | Base | Sel |
|---|---|---|---|
| Formule chimique | Un hydrogène |(\text{H})| et un non-métal | Un métal et un groupe hydroxyle |(\text{OH})| | Un métal et un non-métal |
| Ions libérés en solution aqueuse | Un proton |(\text{H}^+)| et un anion | Un cation et un hydroxyde |(\text{OH}^-)| | Un cation et un anion |
| pH en solution aqueuse | Inférieur à |7| | Supérieur à |7| | Égal à |7| (neutre)* |
| Exemple | Acide chlorhydrique |(\text{HCl})| | Hydroxyde de sodium |(\text{NaOH})| | Chlorure de sodium |(\text{NaCl})| |
Remarque : Un sel dissout dans l’eau ne produit pas toujours une solution neutre. Par exemple, une solution aqueuse de fluorure de sodium |(\text{NaF})| a un pH basique.
La formule chimique d’un acide commence généralement par un hydrogène |(\color{red}{\text{H}})| suivi d’un non-métal.
L’acide fluorhydrique |(\color{red}{\text{H}}\text{F});|
L’acide chlorhydrique |(\color{red}{\text{H}}\text{Cl});|
L’acide iodhydrique |(\color{red}{\text{H}}\text{I}).|
Le fluor |(\text{F}),| le chlore |(\text{Cl})| et l’iode |(\text{I})| sont tous les trois des non-métaux.
La formule chimique d’un acide peut aussi commencer par le symbole de l’hydrogène |(\color{red}{\text{H}})| suivi d’un groupe d’atomes.
L’acide nitrique |(\color{red}{\text{H}}\text{NO}_3);|
L’acide sulfurique |(\color{red}{\text{H}_2}\text{SO}_4).|
La formule chimique de l’acide acétique |(\text{CH}{_3}\text{COO}\color{red}{\text{H}})| se termine par le symbole de l’hydrogène |(\color{red}{\text{H}}).|
Dans l’équation chimique de la dissociation électrolytique d’un acide, on retrouve un proton en phase aqueuse |(\text{H}{^+}{_{\text{(aq)}}}).|
|\text{HF}_{\text{(g)}}\rightarrow\text{H}^{+}{_{\text{(aq)}}}+\text{F}^{-}{_{\text{(aq)}}}|
|\text{H}_2\text{SO}_{4}{_{\text{(l)}}}\rightarrow2\ \text{H}^{+}{_{\text{(aq)}}}\ +\ \text{SO}_{4}{^{2-}}{_\text{(aq)}}|
|\text{CH}_{3}\text{COOH}_{\text{(l)}}\rightarrow\text{H}^{+}{_{\text{(aq)}}}+\text{CH}_{3}\text{COO}^{-}{_{\text{(aq)}}}|
La formule chimique d’une base commence généralement par un métal suivi d’un groupe hydroxyle |(\color{blue}{\text{OH}}).|
L’hydroxyde de lithium |(\text{Li}\color{blue}{\text{OH}});|
L’hydroxyde de sodium |(\text{Na}\color{blue}{\text{OH}});|
L'hydroxyde de calcium |(\text{Ca(}\color{blue}{\text{OH}})_2).|
Le lithium |(\text{Li}),| le sodium |(\text{Na})| et le calcium |(\text{Ca})| sont tous les trois des métaux.
La formule chimique de l’ammoniac |(\text{NH}_3)| ne se termine pas par |\text{OH}.| L’ammoniac réagit avec l’eau |(\text{H}{_2}\text{O})| selon l’équation suivante.
||\text{NH}_{3}{_{\text{(g)}}}+\text{H}_2\text{O}{_\text{(l)}}\rightarrow\text{NH}{_4}^{+}{_{\text{(aq)}}}+\text{OH}^{-}{_{\text{(aq)}}}||
On observe que la réaction de |\text{NH}_3| avec l’eau libère des ions |\text{OH}^-,| alors |\text{NH}_3| est bien une base.
La formule chimique d’une base peut aussi commencer par un groupe d’atomes suivi d’un groupe hydroxyle |(\color{blue}{\text{OH}}).|
L’ammoniaque |(\text{NH}{_4}\color{blue}{\text{OH}})| est formé du groupe d’atomes |\text{NH}{_4}| et du groupe hydroxyle |\text{OH}.|
La formule chimique de l’acide acétique |(\text{CH}{_3}\text{COOH})| se termine par |\text{OH},| mais il ne s’agit pas d’une base. L’acide acétique se dissocie dans l’eau selon l’équation suivante.
||\text{CH}_{3}\text{COOH}_{\text{(l)}}\rightarrow\text{H}^{+}{_{\text{(aq)}}}+\text{CH}_{3}\text{COO}^{-}{_{\text{(aq)}}}||
On observe que la dissociation libère des ions |\text{H}^+,| alors |\text{CH}{_3}\text{COOH}| est bien un acide.
Dans l’équation chimique de la dissociation électrolytique d’une base, on retrouve l’ion hydroxyde en phase aqueuse |(\text{OH}{^-}{_{\text{(aq)}}}).|
Un sel est un électrolyte généralement composé d’un métal et d’un non-métal.
Le fluorure de lithium |(\text{LiF});|
Le chlorure de sodium |(\text{NaCl});|
L’oxyde de calcium |(\text{CaO}).|
Le lithium |(\text{Li}),| le sodium |(\text{Na})| et le calcium |(\text{Ca})| sont tous les trois des métaux.
Le fluor |(\text{F}),| le chlore |(\text{Cl})| et l’oxygène |(\text{O})| sont tous les trois des non-métaux.
La formule chimique d’un sel peut aussi contenir des groupes d’atomes.
Le nitrate de sodium |(\text{NaNO}_3)| est composé de sodium |(\text{Na}),| un métal et du groupe d’atomes |\text{NO}{_3};|
Le chlorure d’ammonium |(\text{NH}{_4}\text{Cl})| est composé du groupe d’atomes |\text{NH}_4| et du chlore |(\text{Cl}),| un non-métal;
Le nitrate d’ammonium |(\text{NH}{_4}\text{NO}{_3})| est composé du groupe d’atomes |\text{NH}_4| et du groupe d’atomes |\text{NO}{_3}.|
Dans l’équation chimique de la dissociation électrolytique d’un sel neutre, on retrouve généralement des ions autres que le proton |\text{H}{^+}{_{\text{(aq)}}}| et l'hydroxyde |\text{OH}{^-}{_{\text{(aq)}}}.|
Le taux de dissociation varie d’un électrolyte à l’autre, ce qui influence la conductibilité électrique d’une solution électrolytique. Plus le taux de dissociation est élevé, plus la solution conduit facilement le courant.
Les électrolytes avec un taux de dissociation très élevé (près de 100 %) sont des électrolytes forts. Les électrolytes avec un taux de dissociation bas sont des électrolytes faibles.
Un électrolyte fort est un électrolyte qui se dissocie presque complètement dans l’eau.
Un électrolyte faible est un électrolyte qui se dissocie partiellement dans l’eau.
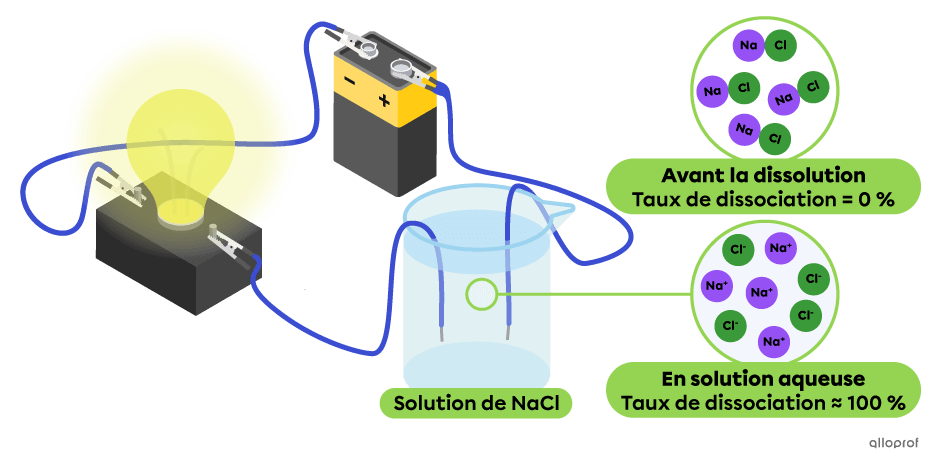
Dans le montage suivant, la totalité des particules de chlorure de sodium |(\text{NaCl})| se sont dissociées en ions |\text{Na}^+| et |\text{Cl}^-.| On observe que cette solution conduit très bien le courant électrique, puisque l’intensité lumineuse de l’ampoule est élevée. Le chlorure de sodium |(\text{NaCl})| est un électrolyte fort.
Dans le montage suivant, un faible pourcentage de particules de chlorure d’argent|(\text{AgCl})| se sont dissociées en ions |(\text{Ag}^+)| et |(\text{Cl}^-)| On observe que cette solution conduit moins bien le courant électrique, puisque l’intensité lumineuse de l’ampoule est faible. Le chlorure d’argent |(\text{AgCl})| est un électrolyte faible.
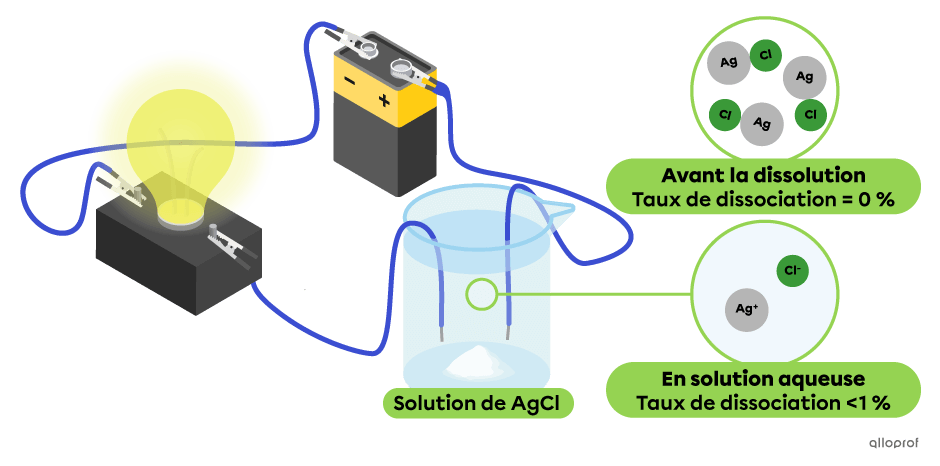
Note : Le taux de dissociation du chlorure d’argent (AgCl) est calculé pour une concentration de 0,1 mol/L.
Le tableau suivant comprend quelques électrolytes forts et leur formule chimique.
|
Type d’électrolyte |
Nom |
Formule chimique |
|---|---|---|
|
Acide chlorhydrique |
|\text{HCl}| |
|
|
Acide sulfurique |
|\text{H}{_2}\text{SO}{_4}| |
|
|
Hydroxyde de sodium |
|\text{NaOH}| |
|
|
Chlorure de sodium |
|\text{NaCl}| |
|
|
Chlorure de potassium |
|\text{KCl}| |
Le tableau suivant comprend quelques électrolytes faibles et leur formule chimique.
|
Type d’électrolyte |
Nom |
Formule chimique |
|---|---|---|
|
Acide fluorhydrique |
|\text{HF}| |
|
|
Acide nitreux |
|\text{HNO}_2| |
|
|
Acide chloreux |
|\text{HClO}_2| |
|
|
Acide acétique |
|\text{CH}{_3}\text{COOH}| |
|
|
Ammoniac |
|\text{NH}_3| |
|
|
Fluorure de sodium |
|\text{NaF}| |
|
|
Chlorure d'argent |
|\text{AgCl}| |
|
|
Dichlorure de plomb |
|\text{PbCl}_2| |