Liste de discussions
-
Vérifiée par Alloprof
Secondaire 5 • 4asalut je ne comprend pas ce probleme
L'acide perchlorique est un acide fort ayant comme formule chimique HClO4. Tu dissous une certaine quantité d'acide perchlorique dans 250mL d'eau. Tu mesures le pH de la solution et obtiens un pH de 1,28.
a) Écris la réaction de l'acide perchlorique avec l'eau.
b) Quelle est la concentration d'ions H3O+ dans la solution acide?
c) Quelle masse d'acide perchlorique a été utilisée pour préparer la solution?
-
Vérifiée par Alloprof
Secondaire 5 • 4aSalut! J'ai besoin d'aide avec ce problème"
Il y 5 bouteilles devant toi, chacune avec une étiquette.
Bouteille A : " Neutre "
Bouteille B : " [H3O+] = 1 x 10-3 mol/L "
Bouteille C : " pOH = 12 "
Bouteille D : " pH = 10 "
Bouteille E : " [OH-] = 1 x 10-5 mol/L "
Classe les bouteilles selon l'acidité de leur contenu, de la plus acide jusqu'à la moins acide. Justifie le classement par quelques phrase et/ou quelques calculs.
-
Vérifiée par Alloprof
Secondaire 5 • 4aJe ne comprend apa ou est mon erreur cest pas bon car 0.04 -0,04 = 0
-
Vérifiée par Alloprof
Secondaire 5 • 4aJe ne suis pas sur si c'Est le dernier ou la trosieme :///ca change de cas en cas certains on dimniue dautre on augmente
-
Vérifiée par Alloprof
Secondaire 5 • 4aJ'au trouvé la oncentration ca donne 4.23, mais ce n'Et pas claire vos explication je ne sais pas quoi faire apres :/comment je fais ça :/
-
Vérifiée par Alloprof
Secondaire 5 • 4aCOmment je fais ce numero :/
-
Vérifiée par Alloprof
Secondaire 5 • 4aJe ne suis pas sur si c'Est le dernier ou la trosieme :///Je sais que ca oppose mais de quelle facon ene diminuant au augmentant la modification
-
Vérifiée par Alloprof
Secondaire 5 • 4acomment je fais ça :/
MErci
-
Vérifiée par Alloprof
Secondaire 5 • 4aJe ne suis pas sur si c'Est le dernier ou la trosieme :///
-
Vérifiée par Alloprof
Secondaire 5 • 4aJe ne comprends pas savoir logiquement c'Est le x non?
-
Vérifiée par Alloprof
Secondaire 5 • 4aBOnjour,
Je ne suis as sur ce,st le quelle car logiquement la loi de la conservation de la matiere est vlide pour tout...?
-
Vérifiée par Alloprof
Secondaire 5 • 4aBonjour, je n'arrive pas à trouver la réponse a cette question...
Explique la température (basse ou élevée) d’ébullition de H2SiO3.
Merci d'avance :)
-
Vérifiée par Alloprof
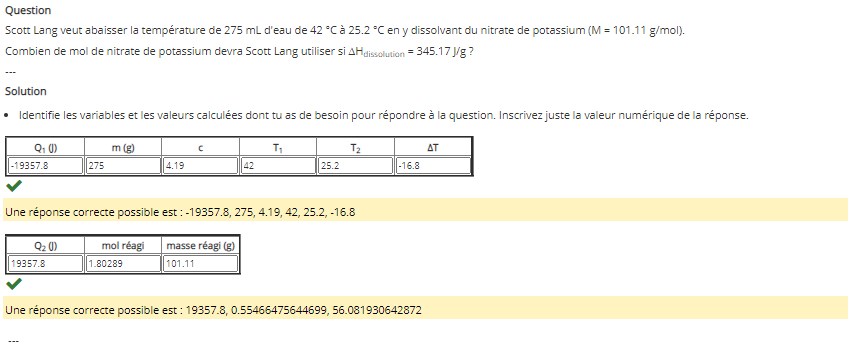
Secondaire 5 • 4aBonjour, dans cet exerciceCela est ma démarche:Mon prof m'a dit que j'ai la mauvaise variation de température pour mon concentré mais je me demande quel est le bon? Et est-ce que ma démarche est bonne?
Merci
-
Vérifiée par Alloprof
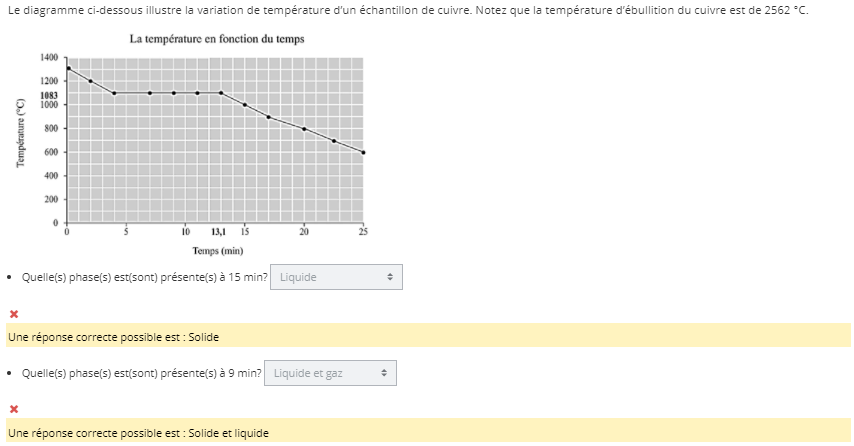
Secondaire 5 • 4aBonjour,Je ne comprends pas comment savoir quelle est la phase qui est présente? Pourrez-cous me dire?
Merci,
-
Vérifiée par Alloprof
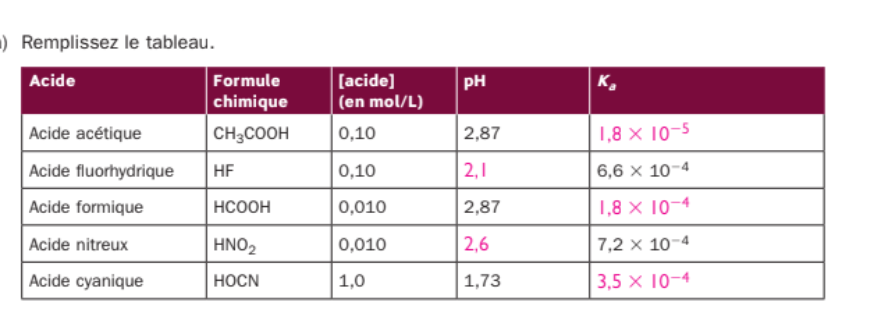
Secondaire 5 • 4aBonjour,Dans cette question, je ne comprends pas comment trouver les réponses dans le deuxième tableau? On me dit que les réponses écrite sont bonne mais le corrigé (partie jaune dit quelque chose de différent). Pourrez-vous me dire lequel est-bon et comment trouvez les données comme je ne me rappelle plus?
Merci
-
Vérifiée par Alloprof
Secondaire 5 • 4aBonjour,
Pouvez-vous m'aider à le faire? Me dire comment je sais qui est le plus acides :/?
-
Vérifiée par Alloprof
-
Vérifiée par Alloprof
Secondaire 4 • 4aPourquoi est-ce que dans une réaction de neutralisation avec de l'acide sulfurique 0,2 mole et de l'hydroxyde sodium 0,5 mole on obtient une substance avec un pH de 2?
-
Vérifiée par Alloprof
Secondaire 5 • 4aBonjour, j'ai un numéro de révision en chimie
Celui-ci va comme suit:
Dans une expérience particulière, un contenant de 1,00L contient 300g de diazote. La pression atteint 29 000kPa a 100 degrés Celsius. En supposant que le diazote reste gazeux, déterminez s'il se comporte comme un gaz parfait. Justifiez votre réponse.
Je pense qu'il faut utilisé la formule de PVnRT, mais ne comprend pas comment justifier que le gaz soit parfait.
-
Vérifiée par Alloprof
Secondaire 5 • 4aBonjour!
Je n'ai pas bien compris l'une des trois conditions (dont la première, contenir une réaction réversible) nécessaires à l'obtention de l'équilibre chimique et le principe de Le Chatelier...
Merci d'avance!
-
Vérifiée par Alloprof
Secondaire 5 • 4abonjour,
J'aimerais savoir pour la reactivité des gaz si on met dit classe en ordre de celui qui a une plus grande reactivite chimiue entre le F2,O2, Cl2, je dirais que c'est le F2 ensuite le Cl2 et puis le O2.Pourreiez vous me corriger? Je ne suis pas sur si on doit regarder de gauche a droit de de bas en haut en premier. Aussi, ecq c'est possible que on me demnade de classer le Br2 aussi meme si ce n'est pas un gaz?
-
Vérifiée par Alloprof
Secondaire 1 • 4aBonjour je voudrais savoir quelles sont les étapes de la méthode scientifique étant doné que je suis en secondaire 1. Merci!
-
Vérifiée par Alloprof
Secondaire 3 • 4aBonjour à tous ! J'ai besoin de savoir à quoi sert le test au NaHCO3 et KOH dans la nutrition chez les autotrophes et plus précisément chez les plantes chlorophylliennes. Merci à vous !
-
Vérifiée par Alloprof
Secondaire 5 • 4aBonjour, je ne comprends pas comment je suis supposé de trouver les reponses.
-
Vérifiée par Alloprof
Secondaire 5 • 4aj'aimerais savoir lequel est le plus reactif entre O2,F2,Br2,H2 ,Ar,Kr?
C'est en lien avec la notion de reactivite chimique. Il n'y a pas d'exemple dans vos fiches
-
Vérifiée par Alloprof
-
Vérifiée par Alloprof
Secondaire 5 • 4aAu cours d’un titrage on ajoute 40 mL d’une solution d’hydroxyde de sodium Ca(OH)2(aq) 0,200mol.L-1 à 60 ml d’acide chlorhydrique à 0,08 mol/L
a) La solution obtenue est-il neutre? Acide ou basique ?
b) Quel est le pH de la solution obtenue ?
-
Vérifiée par Alloprof
Secondaire 5 • 4aBonjour j'ai besoin de l'aide ave cette question...
volume d’une solution d’hydroxyde de calcium, Ca(OH)2(aq) 0,200mol.L-1 faut-il utiliser pour neutraliser completement 25,0ml d'acide chloridrique HCL(aq)0,100 mol.L-1?
Merci!!
-
Vérifiée par Alloprof
Secondaire 5 • 4aBonjour. Je me demandais pourquoi un ajout ou un retrait d’une certaine quantité d’un réactifs ou d’un produits en phase liquide ou solide n’influe pas sur la vitesse de réaction... il me semble que plus il y en a, plus la réaction de déroule rapidement non?
Je ne comprenais pas la réponse de l’autre prof, il ne parlait nul part, dans son explication, de phase liquide ou solide...
-
Vérifiée par Alloprof
Secondaire 5 • 4aBonjour. Je me demandais pourquoi un ajout ou un retrait d’une certaine quantité d’un réactifs ou d’un produits en phase liquide ou solide n’influe pas sur la vitesse de réaction... il me semble que plus il y en a, plus la réaction de déroule rapidement non?