Matières
Niveaux
Selon la théorie des collisions, la vitesse d’une réaction chimique est directement proportionnelle au nombre de collisions efficaces entre les particules de réactifs.
En laboratoire, des facteurs peuvent être modifiés afin de faire varier le nombre de collisions efficaces et donc la vitesse de réaction.
Le tableau suivant décrit de manière générale comment certains de ces facteurs influencent la vitesse de réaction.
Clique sur l’un des facteurs pour en voir les détails.
|
Facteur |
Augmentation de la vitesse de réaction |
Diminution de la vitesse de réaction |
|---|---|---|
|
Forte concentration |
Faible concentration |
|
|
Peu de liaisons chimiques à briser |
Grand nombre de liaisons chimiques à briser |
|
|
Liaisons faibles |
Liaisons fortes |
|
|
Énergie cinétique élevée |
Énergie cinétique basse |
|
|
Faible attraction entre les particules |
Forte attraction entre les particules |
|
|
Grande surface de contact |
Petite surface de contact |
|
|
Température élevée |
Température basse |
|
|
Présence d’un catalyseur |
Présence d’un inhibiteur |
En général, une augmentation de la concentration d’un réactif entraine une augmentation de la vitesse de réaction.
En effet, une augmentation du nombre de particules de réactifs dans un volume donné entraine généralement un nombre de collisions plus élevé, ce qui augmente la probabilité qu’il y ait des collisions efficaces.
Faible concentration des réactifs
Forte concentration des réactifs
Le nombre de liaisons à briser, la force des liaisons, la force d’attraction entre les particules et l’énergie cinétique des particules sont tous des facteurs qui influencent l’énergie d’activation. Par le fait même, ils influencent la vitesse de réaction.
Plus l’énergie d’activation est basse, plus la réaction chimique est rapide.
Plus l’énergie d’activation est élevée, plus la réaction chimique est lente.
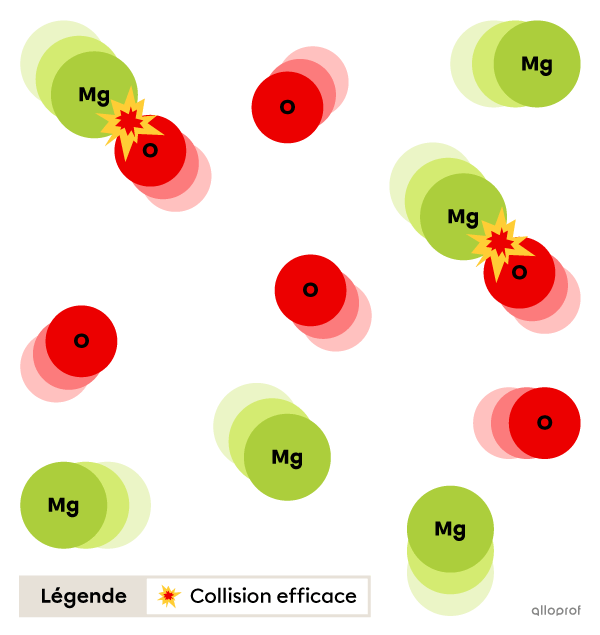
Énergie d’activation (Ea) basse
Lorsque l’énergie d’activation |(E_a)| est basse, davantage de particules possèdent l’énergie requise pour faire des collisions efficaces. Plus le nombre de collisions efficaces entre les réactifs est élevé, plus la réaction sera rapide.
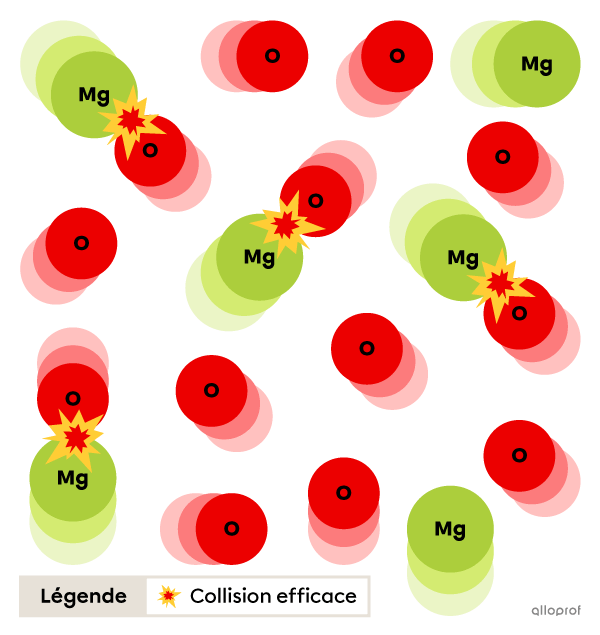
Énergie d’activation (Ea) élevée
Lorsque l’énergie d’activation |(E_a)| est élevée, moins de particules possèdent l’énergie requise pour faire des collisions efficaces. Moins le nombre de collisions efficaces entre les réactifs est élevé, plus la réaction sera lente.
Le nombre de liaisons chimiques à briser, ainsi que la force des liaisons varient en fonction de la nature des réactifs impliqués dans une réaction chimique.
Lorsqu’on compare des molécules semblables, plus il y a de liaisons chimiques à briser dans les réactifs, plus l’énergie d’activation est élevée. Ainsi, la vitesse de réaction est plus lente.
Dans des conditions de réaction semblables, la combustion du propane |(\text{C}_3\text{H}_8)| est plus lente que celle du méthane |(\text{CH}_4).| En effet, le nombre de liaisons à briser est plus grand dans une molécule de |\text{C}_3\text{H}_8| que dans une molécule de |\text{CH}_4.|
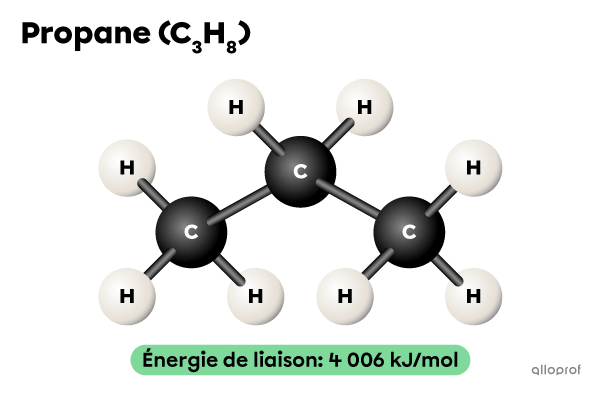
Il faut fournir au minimum |4\ 006\ \text{kJ}| d’énergie pour briser les 10 liaisons chimiques de chaque molécule d’une mole de |\text{C}_3\text{H}_8.|
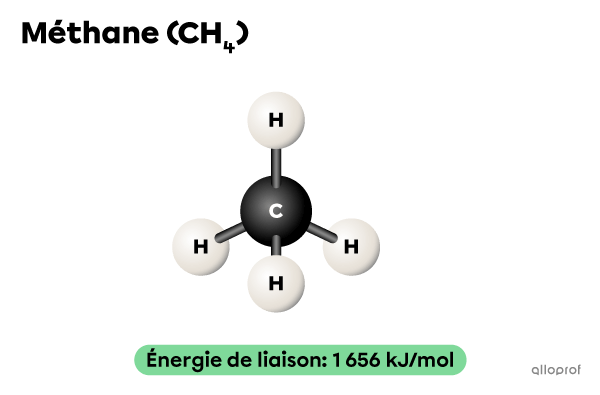
Il faut fournir |1\ 656\ \text{kJ}| d’énergie pour briser les 4 liaisons chimiques présentes dans chaque molécule d’une mole de |\text{CH}_4.|
Plus l’énergie de liaison des réactifs est faible, plus l’énergie d’activation de la réaction est basse et plus la vitesse de réaction est rapide.
L’énergie de liaison du bromure de sodium |(\text{NaBr})| est plus élevée que l’énergie de liaison de l’iodure de sodium |(\text{NaI}).|
Lorsque ces deux composés réagissent avec le chlorométhane |(\text{CH}_3\text{Cl}),| la réaction avec |\text{NaI}| est plus rapide que la réaction avec |\text{NaBr}.|
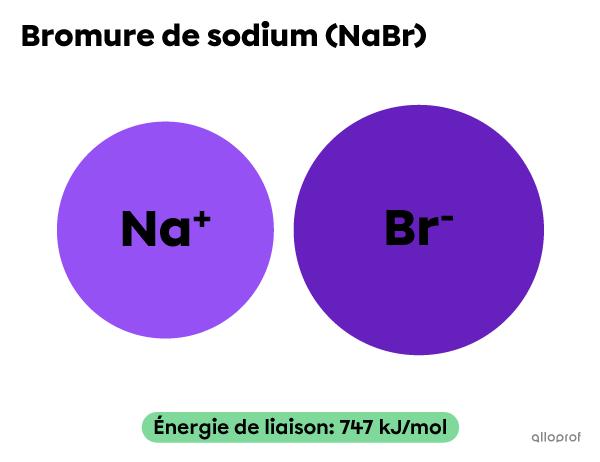
||\text{CH}_3\text{Cl}+\text{NaBr}\rightarrow \text{CH}_3\text{Br}+\text{NaCl}||
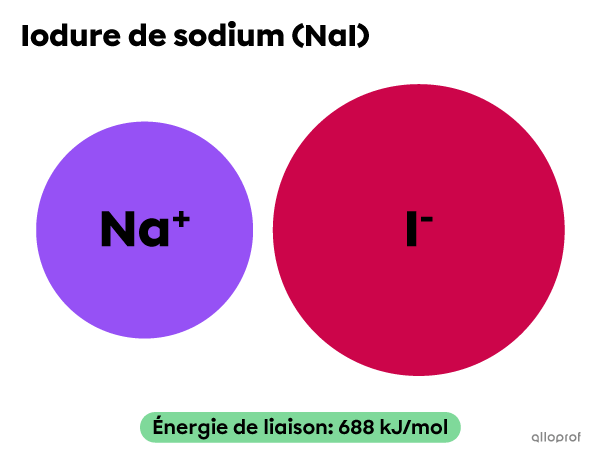
||\text{CH}_3\text{Cl}+\text{NaI}\rightarrow \text{CH}_3\text{I}+\text{NaCl}||
La force d’attraction entre les particules d’une substance ainsi que l’énergie cinétique des particules varient en fonction de l’état physique de cette substance.
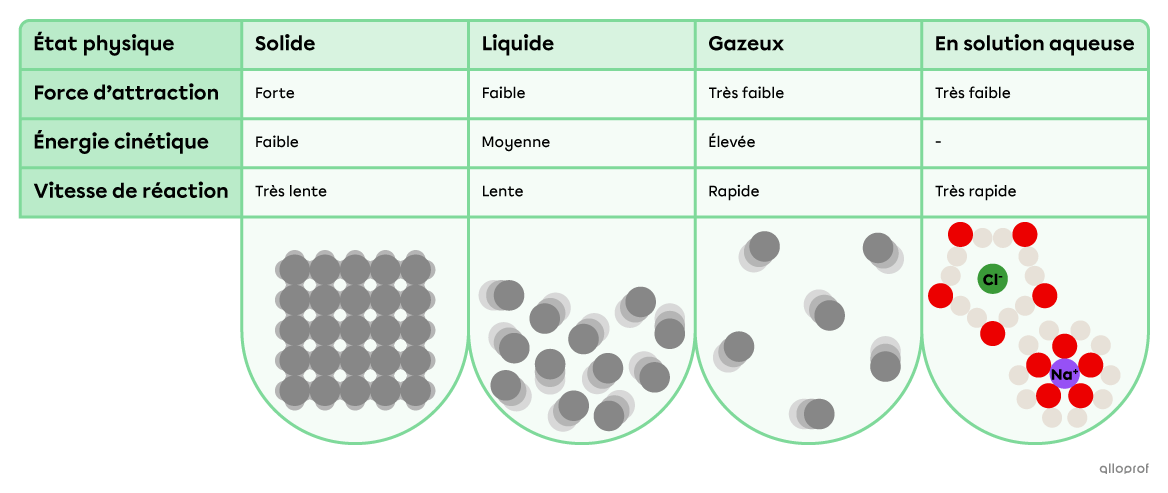
Comparaison des propriétés d’une même substance en fonction de son état.
Plus les forces d’attraction entre les particules de réactifs sont fortes, plus la quantité d’énergie nécessaire pour briser ces forces sera importante, plus l’énergie d’activation de la réaction sera élevée et plus la vitesse de réaction sera lente.
Selon le modèle particulaire, les forces d’attraction sont plus grandes entre les particules d’une substance solide qu’entre les particules de cette même substance à l’état liquide ou à l’état gazeux. De plus, lorsqu’un composé ionique est dissocié en solution, les forces d’attraction entre les ions sont significativement réduites.
Les particules dont l’énergie cinétique est élevée ont plus de chances d’atteindre un niveau d’énergie supérieur ou égal à l’énergie d’activation |(E_a)| de la réaction.
Selon le modèle particulaire, l’état physique d’une substance influence l’énergie cinétique de ses particules.
À l’état solide, l’énergie cinétique des particules est très faible. En effet, les particules d’un solide font uniquement un mouvement de vibration sur place.
À l’état liquide, l’énergie cinétique des particules est faible. En effet, tout en demeurant très rapprochées, les particules d’un liquide peuvent glisser les unes par rapport aux autres.
À l’état gazeux, l’énergie cinétique des particules est très élevée. En effet, les particules d’un gaz peuvent se déplacer à grande vitesse dans toutes les directions de manière aléatoire.
Lorsque l’un des réactifs est à l’état solide, seules les particules à la surface du solide peuvent entrer en contact avec les particules des autres réactifs. Fragmenter un réactif solide permet d’augmenter sa surface de contact avec les autres réactifs, ce qui expose davantage ses particules aux collisions. En permettant un plus grand nombre de collisions, le nombre de collisions efficaces augmente également, ce qui augmente la vitesse de réaction.
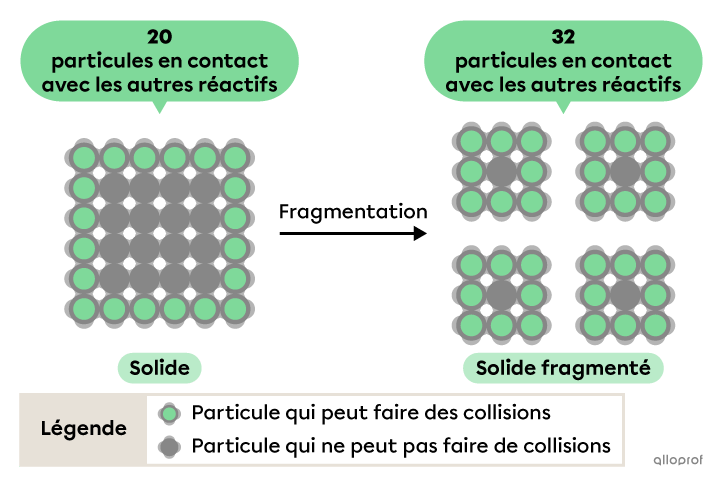
Selon la théorie des collisions, la vitesse d’une réaction chimique dépend, entre autres, de l’énergie cinétique des particules de réactifs.
La température est un indice du degré d’agitation des particules. Augmenter la température du milieu réactionnel permet donc d’augmenter l’énergie cinétique des particules de réactifs, ce qui tend à augmenter le nombre de collisions efficaces et la vitesse de réaction.
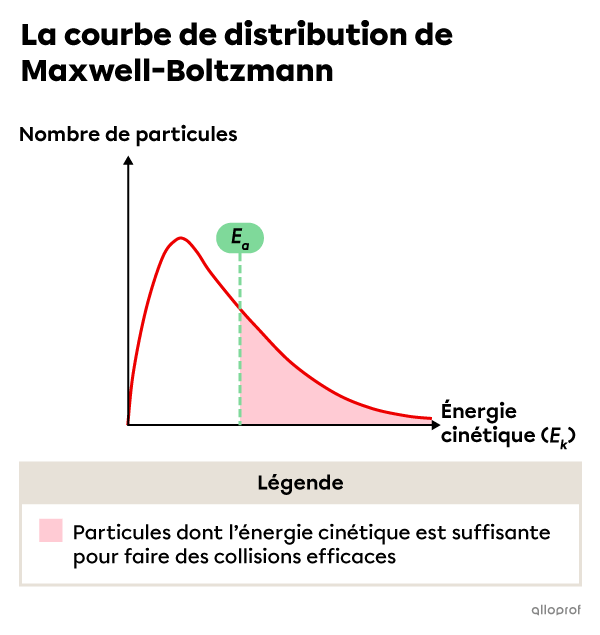
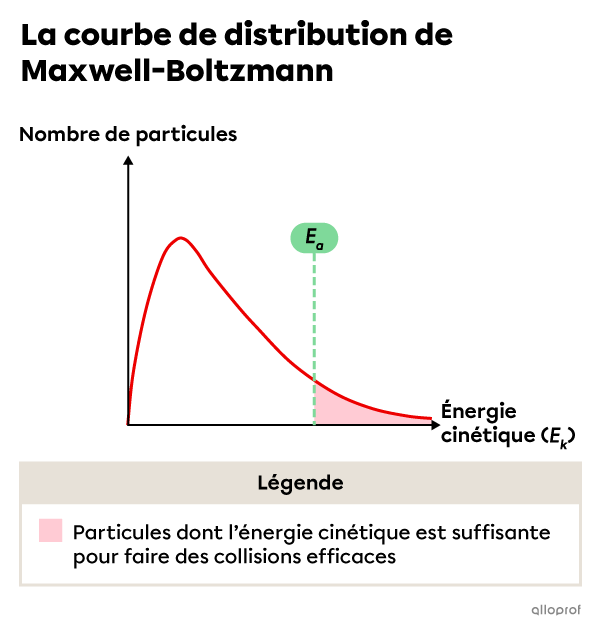
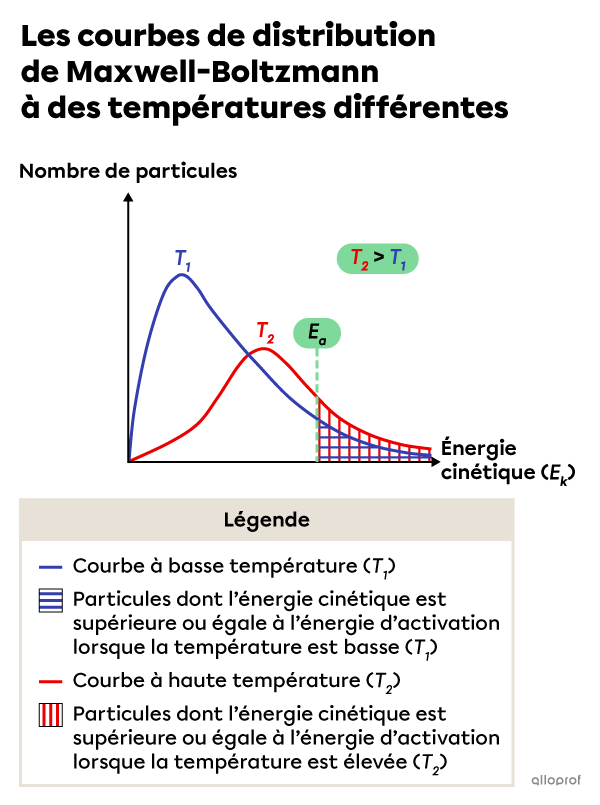
La courbe de distribution de Maxwell-Boltzmann permet de visualiser l’énergie cinétique des particules de réactifs lorsqu’on fait varier la température du milieu réactionnel.
On constate que lorsque la température du milieu réactionnel est plus élevée, un plus grand nombre de particules de réactifs ont une énergie cinétique égale ou supérieure à l’énergie d'activation |(E_a)| de la réaction.
Le réfrigérateur permet d’abaisser la température des aliments afin de ralentir les réactions de fermentation et d’oxydation de certains aliments.

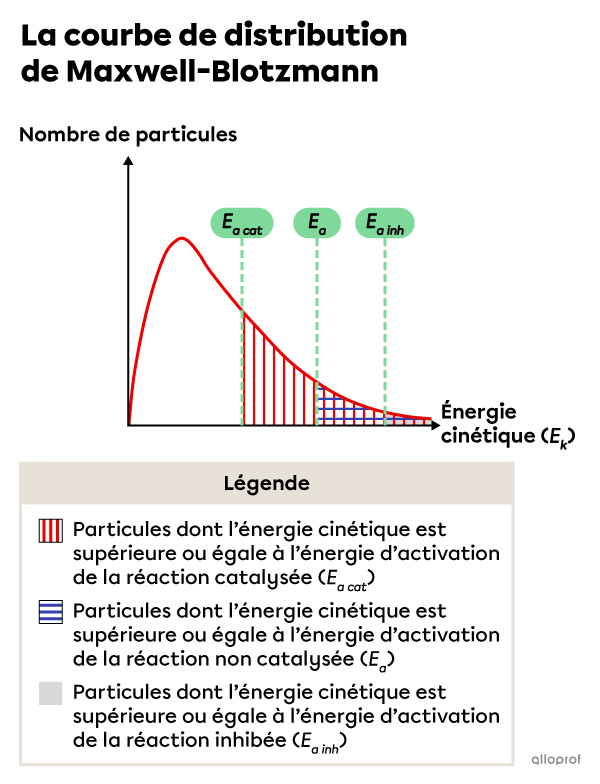
Un catalyseur est une substance qui augmente la vitesse d’une réaction chimique en diminuant son énergie d’'activation, sans être consumée dans le processus.
Un inhibiteur a l’effet inverse d’un catalyseur, c’est-à-dire qu’il diminue la vitesse d’une réaction chimique en augmentant son énergie d’activation, sans être consumé dans le processus.
Selon la théorie des collisions, la vitesse d’une réaction est directement proportionnelle au nombre de collisions efficaces.
En abaissant l’énergie d’activation d’une réaction |(E_{a\ cat}),| l’ajout d’un catalyseur permet à un plus grand nombre de particules de réactifs d’atteindre le niveau d’énergie requis pour faire des collisions efficaces. Ainsi, la réaction est plus rapide.
En augmentant l’énergie d’activation d’une réaction |(E_{a\ inh}),| l’ajout d’un inhibiteur permet à un moins grand nombre de particules de réactifs d’atteindre le niveau d’énergie requis pour faire des collisions efficaces. Ainsi, la réaction est plus lente.
Consulte cette fiche notionnelle pour en apprendre davantage sur l’effet des catalyseurs sur la vitesse de réaction et sur les types de catalyseurs.