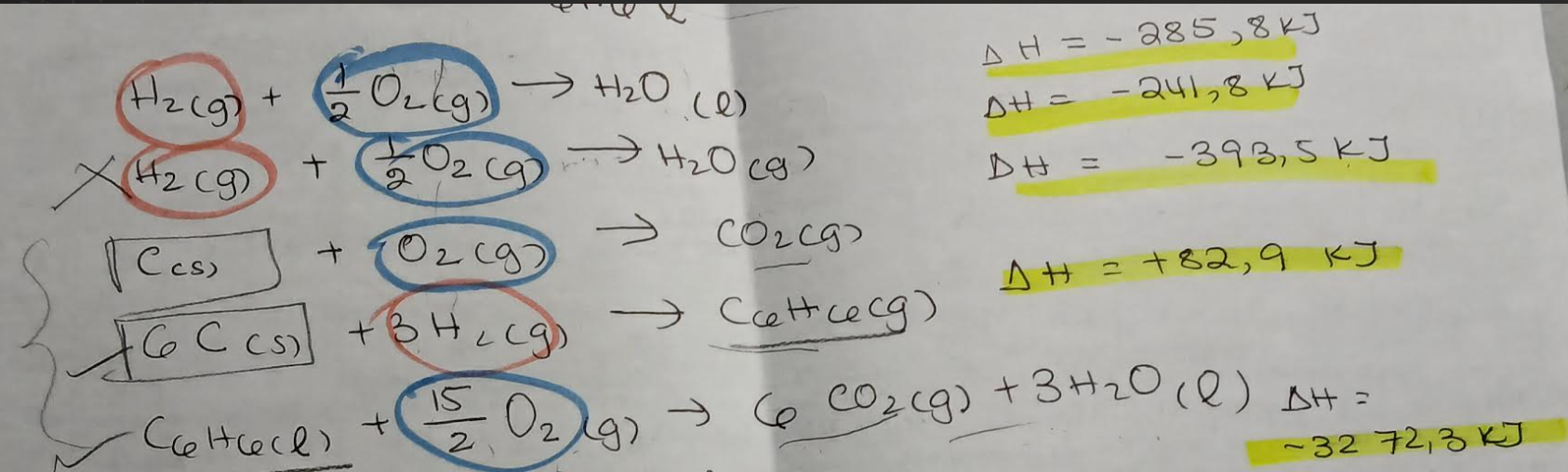Liste de discussions
-
Vérifiée par Alloprof
Primaire 5 • 10mje suis en 5e année primaire et je suis capable de jouer
au jeu réaction solitare et j'arrive même a ouvrir les caisse rouge
-
Vérifiée par Alloprof
Secondaire 5 • 10mQu’est ce que le calcul de l’erreur expérimentale?
-
Vérifiée par Alloprof
Secondaire 5 • 10mBonjour!
Je fais un laboratoire en chimie sur la vitesse de réaction. Lors de ce laboratoire, nous devions mélangé du magnésium solide avec du HCl aqueux pour créer MgCl2 et du H2 (nous devions observer les bulles d'aire d'H2 dans une burette à gaz). À l'aide de calculs je devais déterminer si la vitesse était restée constante durant toute la réaction. Mes résultats ont démontrer que la réaction est plus rapide au début et sa vitesse diminue graduellement, par contre je ne comprends pas pourquoi cette vitesse diminue. J'ai regardé tous les facteurs qui ont une influence sur la vitesse de réaction et je ne trouve pas celui que je dois 'utiliser'.
Aidez moi à comprendre s'il vous plaît.
-
Vérifiée par Alloprof
Secondaire 5 • 10mQu’est ce que l’erreur expérimentale complet?
-
Vérifiée par Alloprof
Secondaire 5 • 10mBonsoir,
Est-ce que vous pouvez m’aider avec cette question? Je ne sais pas comment le faire 😬
Merci beaucoup et bonne soirée :)
-
Vérifiée par Alloprof
Secondaire 5 • 10mDans mon cours de chimie à l’école secondaire de Charlevoix, nous avions un laboratoire sur les facteurs qui influencent la vitesse d’une réaction. Nous devions prouver comment la surface influence la vitesse de réaction. Nous avions donc comme réactif du NaHCO3 et du HCL. Pour prouver, nous avons réduit la pastille de base en poudre pour 1g de cette substance et l’avons mis dans l’acide le tout sur la balance. Ensuite, nous avons démarrer le chronomètre. Après 30 secondes, nous avons noter la nouvelle masse. La différence de masse est celle du CO2 qui est parti dans l’air. Quelle pourrait être des sources d’erreurs outre l’imprécision des instruments de mesures? En changeant la surface, y’aurait t’il d’autre facteur qui ont été influencé et qui on pu fausser nos résultats?
-
Vérifiée par Alloprof
Secondaire 5 • 10mBonjour! J'ai un labo et ca me demande de calculer la vitesse en mol/L x s, mais j'ai seulement la concentration intiale. Comment es-ce que je trouve la concentration finale ou la vitesse en mol/L x s si j'ai seulement la vitesse en mol/s d'une autre reactif dans la reaction?
-
Vérifiée par Alloprof
Secondaire 5 • 10mBonjour!
Quelles pourraient être les sources d’erreur dans ce laboratoire?
-
Vérifiée par Alloprof
Secondaire 3 • 10mQu'elle est la réaction lorsque je mélange du sulfure et du sel
-
Vérifiée par Alloprof
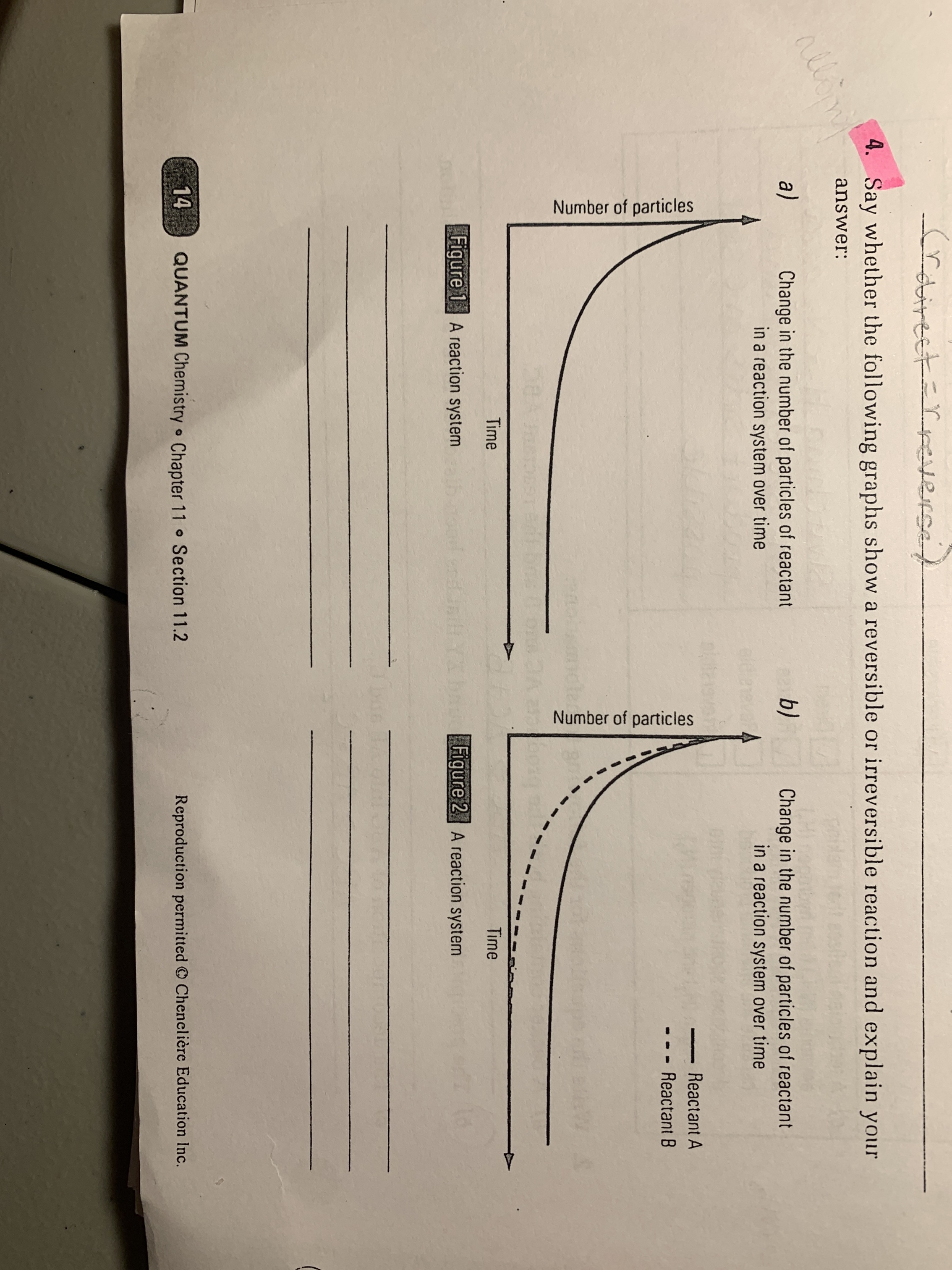
Secondaire 5 • 10mRe-bonjour!
J'avais quelques questions sur le chapitre de chaleur de réaction et la loi de hess; les-voici:
1) Je ne comprendsabsolumentpasc'est quoi lacapacité calorifique d'un calorimètre.Il y a certains facteurs qui me bloquent et donc, voici l'extrait du cahier que je ne comprends pas:De un,pourquoi est-ce qu'on parle de calculer la chaleur dégagée ou absorbée par le calorimètre,alors qu'on utilise toujours l'eau comme outilpour mesure la chaleur impliquée dans une réaction,à l'aide de la formule Q=mcΔT?Aussi, je ne comprends paspourquoi (surligné en jaune),il estnécessaire de tenir en compte la masse et la capacité thermique massique d'autres matériaux constituant la bombe calorimétrique, alors que la réaction se passe dans un milieu contenant de l'eau?En quoi est-ce que la capacité calorifique est différent de la capacité thermique massique?2) Est-ce qu'il faut absolument toujours avoir l'équation globale avant de manipuler les équations partielles?
Je veux donne deuxexemples rapidesdans lesquels je ne suis pas sûre...Si la question me dit uniquement de déterminer l'équation thermique globale de chaque réaction, alors est-ce qu'en additionnant les substances entre eux, ce que j'aurais, ça serait l'équation globale?Car ici, je n'ai pas de référances sur le nombre de moles à multipiler en suivant une équation de départ par ex.Alors que,si j'ai un exercice comme ceci, est-ce que je dois m'imposer une équation globale pour me guider dans les calculs avec les équations partielles?Merci énormémentpour apporter ces clarifications :D
-
Vérifiée par Alloprof
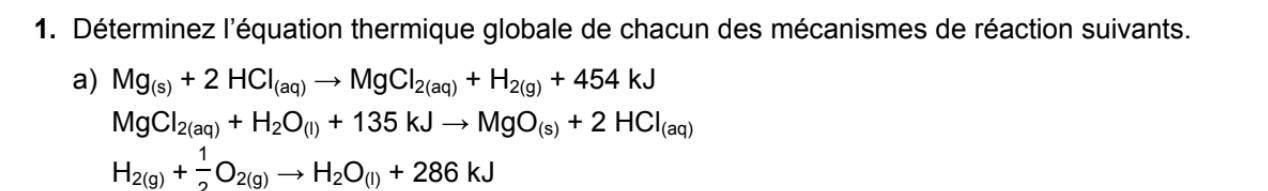
Secondaire 5 • 10mBonjour!
J'ai un exercice sur la loi de Hess qui m'a vraiment mélangé; la-voici:
Dans l'exercice suivant,jai été capable de déterminer l'équation globale (l'équation de la vaporisation du benzène en vert).Déjà, comme vous pouvez le voir dans ma démarche en haut, même après avoir additioné et soustrait les substances de chaque côté,je n'arrive pas à éliminer comme par ex le CO2 et le H2O. Je ne comprends pas comment je peux jouer avec les coefficients stoéchiométriques, alors que mon équation globale est vraiment simple avec juste 1 mol comme coefficient et pas d'autres éléments.Une autre chose, c'est que notre enseignant en classe nous a mentionnéqu'il est inutile d'utiliser la deuxième équation lors des calculs. Mais, pourquoi on n'en a pas besoin?Puis, si il y a des cas similaires qui se présententdans des futurs exercices, comment est-ce que je peux le savoir?Merci, j'ai vraiment besoin de le comprendre :D
-
Vérifiée par Alloprof
Secondaire 5 • 10mBonsoir, je ne comprend pourquoi l'unite de mesure que l'on utilise lorsque que lon fait des fait des calculs pour trouver la vitesse de reaction est mol/litre x secondes(quand c'est une concentration) au lieu de mol/litre/seconde.Ces deux unite de mesures sont elle les meme? Pourquoi est ce que l'on utilise la premiere.Quand je fait les calculs je trouve mol/litre/seconde.
-
Vérifiée par Alloprof
Postsecondaire • 10mBonjour, j'aimerais citer cet article:https://www.alloprof.qc.ca/fr/eleves/bv/sciences/la-technique-de-neutralisation-d-une-solution-tit-s1509, mais je ne trouve pas l'auteur ni la date de publication. Pouvez-vous m'aider?
Merci!
-
Vérifiée par Alloprof
Secondaire 5 • 10mBonsoir , on a realise récemment un laboratoire sur la loi de Hess , mais après les manipulations je ne sais pas du tout ce qu'il faut faire et le prof refuse d'expliquer, je joins ci dessous le laboratoire .
-
Vérifiée par Alloprof
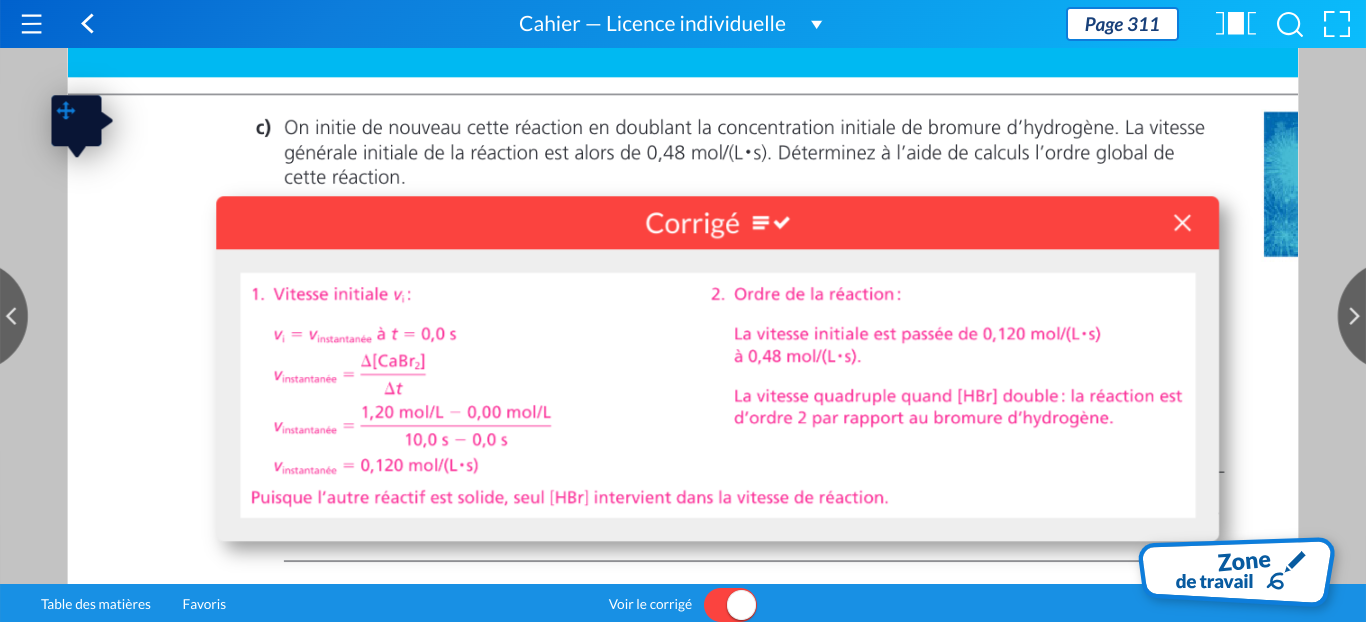
Secondaire 5 • 10mPourquoi l’ordre de réactif est de 0 pour le c alors que dis on regarde l’expérience 1 et 3, j’ai trouvé que l’ordre du réactif c est de 3?
-
Vérifiée par Alloprof
Postsecondaire • 10mPourquoi l'Acide benzoïque est-il plus soluble dans l'éther et peu soluble dans l'eau?
-
Vérifiée par Alloprof
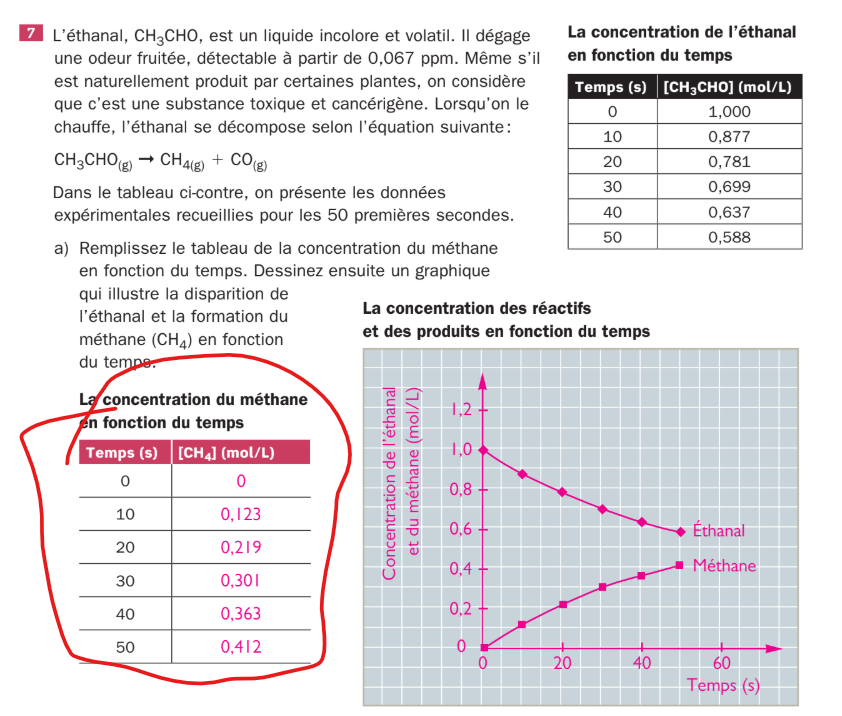
Secondaire 5 • 10mComment ils ont fait pour trouver les données dans le tableau ? :
-
Vérifiée par Alloprof
Secondaire 3 • 10mComment on fait pour trouver C2 dans une dilution svp
-
Vérifiée par Alloprof
Secondaire 5 • 10mBonjour je suis entrain de faire des exercises pour me pratiquer pour mon examen de demain je suis pas trop sur je suis confus entre le b) et c)
Car comme scn est incolore est ce que ça concentration a augmenté ou diminuer
-
Vérifiée par Alloprof
Secondaire 5 • 10mJ’ai une question, est ce que l’ordre global d’un des réactifs doit être toujours de 2? Dans cette image, je ne comprends pas trop pourquoi l’ordre global H2 est de 1 et le NO est de 2
-
Vérifiée par Alloprof
Secondaire 5 • 10mJe ne comprends pas cette question.Pourquoi les autres choix sont faux ? Merci d'avance.
-
Vérifiée par Alloprof
Secondaire 2 • 10mC’est quoi la différence entre chimique, physique et science générales?
-
Vérifiée par Alloprof
Postsecondaire • 10mJ’ai des doute sur comment faire la simplification de cette équation et par après son incertitude. Merci!
-
Vérifiée par Alloprof
Secondaire 3 • 11mBonjour,
Pourquoi les ions (sauf H+) acquièrent-ils une structure proche de celle des gaz nobles?
Merci.
-
Vérifiée par Alloprof
Secondaire 5 • 11mBonsoir aloprof,
je ne comprend pas la démarche au numèro c). Pouver-vous m'expiqué? Merci
-
Vérifiée par Alloprof
Secondaire 5 • 11mAllô, je ne comprends pas la loi de Hess et le principe d’additionner et de soustraire une équation
-
Vérifiée par Alloprof
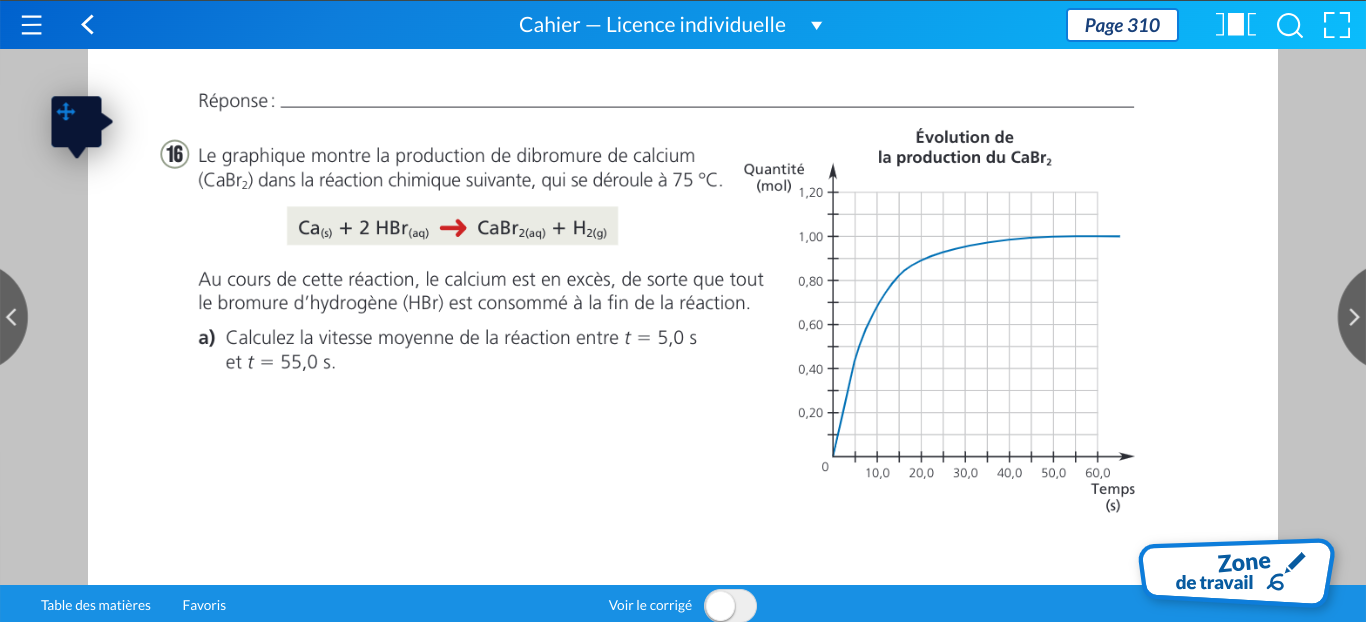
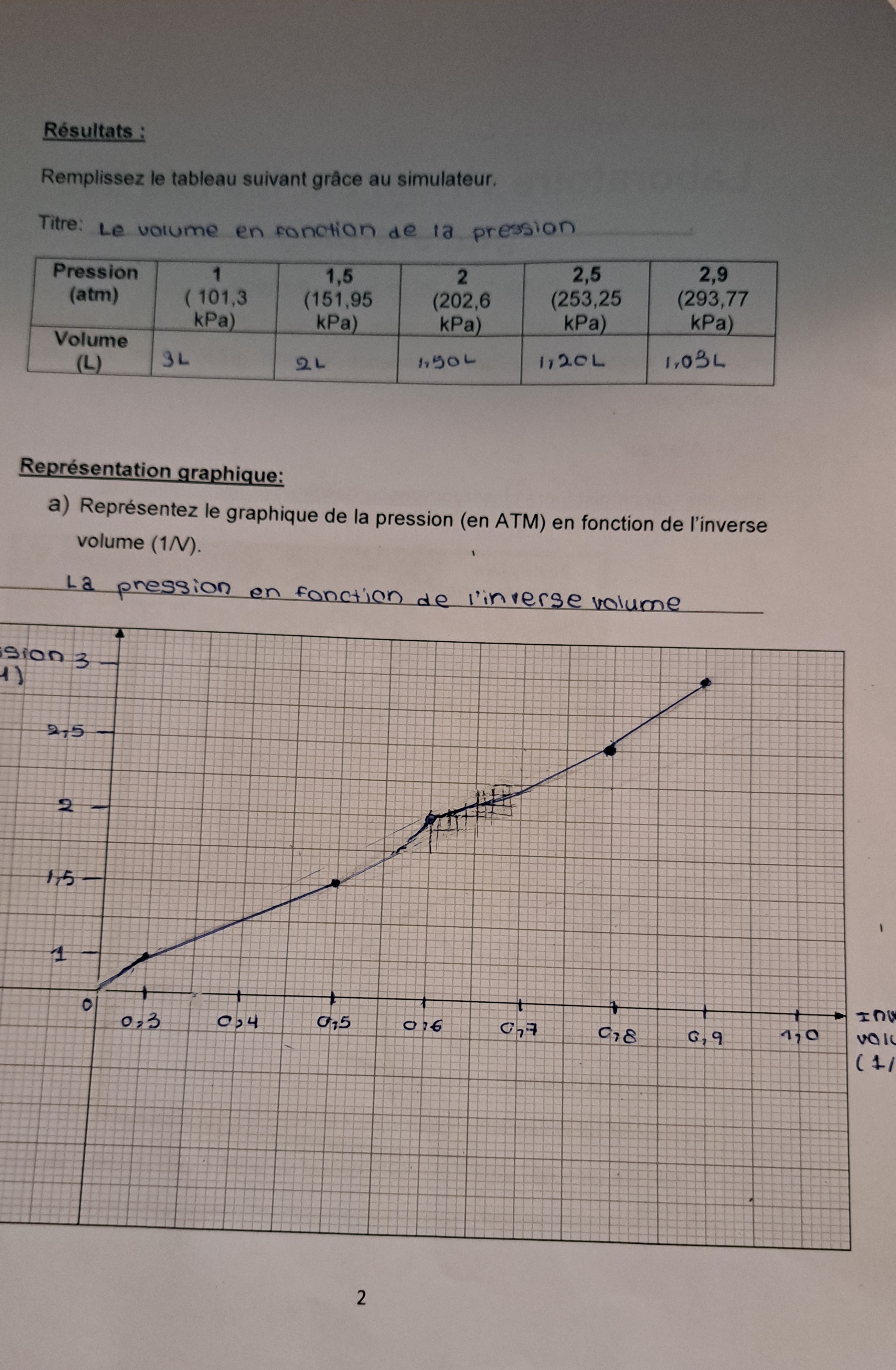
Secondaire 5 • 11mBonjour, est ce que mon graphique est correct? et si je veux connaitre la règle de cette situation est ce que je dois utiliser des points avec le volume ou l'inverse volume?
Merci.
-
Vérifiée par Alloprof
Secondaire 5 • 11mOn a fait un laboratoire sur l’étude de réaction de décomposition peroxyde d’hydrogène dont le but est de vérifier la relation mathématique entre la température du H2O2 et la vitesse du décomposition du peroxyde d’hydrogène. Dans le laboratoire ont devait verser du KL d’hydrogène dans un erlenmeyeur, activer la réaction et le gaz d’O2 dégagé il est passé dans un tube qui fait sorte que l’eau dans le ballon ressortait d’un autre tube et se versait dans un grand cylindre graduée et comme on était deux personnes on devait savoir quel temps prenez la réaction pour atteindre un certain volume comme par exemple combien de temps après le début de la réaction on a pu produire 20 ml d’O2 ,30 ml etc. et on a noté tous nos résultats et on a commencé dans deux autres conditions, où on a d’abord tremper l’erlenmeyeur dans la glace et dans l’eau tiède. Ensuite on devait faire quelques calculs pour chaque condition température de la pièce glace et eau tiède. On devait trouver le nombre de moles pour chaque volume et au final on se retrouve avec une question qui est « trouver la vitesse de réaction de chaque substance à température de la pièce» je n’ai pas trop compris ce qu’elle veut dire ni même comment je devrais procéder. la deuxième question est « quelle est la vitesse générale pour cette réaction pour chacune des températures.» Déjà le problème c’est que les deux questions sont presque similaires et je ne comprends pas ce qu’il veut dire par chaque substance dans la première question non plus. Comme par exemple dans mon tableau des résultats, dans la température de la pièce, j’ai obtenu pour : 20 ml en 19secondes, 30 ml en 26 s, 40 ml en 30s, 50 ml en 34s, 60ml en 38s, 70ml en 41 s, 80ml en 45s, 90 ml en 49s, 100ml en 52s, 110ml en 56s et 120ml en 60s. Dans ce même tableau j’ai deux autres rangées pour la glace (12 degré) et l’eau tiède (44 degré) ou j’ai mesurer le temps nécessaire à la production d’un certain volume de O2. Ensuite j’ai trois autres tableau pour chacunes des conditions où on transforme le volume en nombre de mol grâce a la formule pv=nrt. Donc à partir de la, les deux questions mentionnées plus tôt me portent à confusion. Pour être sûr, voici la réaction complète : 2KI + 2H2O2 ==> 2KOH + I2 + O2. Si possible j’aimerais un exemple avec les données que j’ai mentionné plus tôt. Merci de me répondre
-
Vérifiée par Alloprof
Secondaire 5 • 11mSalut!
En laboratoire, il nous est demandé de trouver un moyen d’accélérer la vitesse de réaction entre la craie et le HCl. On nous fournit du HCl concentré à 0,5M (pour la réaction de base) puis ensuite on nous donne du HCl concentré à 1M. Dans la réaction de base, on nous dit d’utiliser25 mLde HCl ayant une concentration de 0,5M.
Si je souhaite accélérer la vitesse de réaction en augmentant la concentration de l’acide chlorhydrique à 1M au lieu de 0,5M, dois-je, en optant pour du HCl concentré à 1M, utiliser le même volume de HCl que j’ai utilisé lors de la réaction de base (soit25mL)? Si oui pourquoi? Si non, pouvez vous m’expliquer pourquoi je ne peux pas garder le même volume de HCl et quel volume je devrais mettre à la place?
Merci!
-
Vérifiée par Alloprof
Secondaire 2 • 11mSalut Dans une réaction chimique je veux savoir comment reconnaître qu'un(des) tel produit doit se former ?